Slide bài giảng KHTN 7 chân trời bài 6: Giới thiệu về liên kết hóa trị (4 tiết)
Slide điện tử bài 6: Giới thiệu về liên kết hóa trị (4 tiết). Kiến thức bài học được hình ảnh hóa, sinh động hóa. Trình bày với các hiệu ứng hiện đại, hấp dẫn. Giúp học sinh hứng thú học bài. Học nhanh, nhớ lâu. Có tài liệu này, hiệu quả học tập của học môn Khoa học tự nhiên 7 chân trời sáng tạo sẽ khác biệt
Bạn chưa đủ điều kiện để xem được slide bài này. => Xem slide bài mẫu
Tóm lược nội dung
CHỦ ĐỀ 2. PHÂN TỬ
BÀI 6: GIỚI THIỆU VỀ LIÊN KẾT HÓA HỌC
1. VỎ NGUYÊN TỬ KHÍ HIẾM
Câu 1: Trừ helium, vỏ nguyên tử của các nguyên tố còn lại ở Hình 6.1 có những điểm giống và khác nhau gì?
Trả lời rút gọn:
Giống: Đều có 8 electron ở lớp ngoài cùng.
Khác: ở số lớp electron và số electron có trong mỗi lớp: Ne có 2 lớp electron, Ar có 3 lớp electron, Kr có 4 lớp electron, Xe có 5 lớp electron.
2. LIÊN KẾT ION
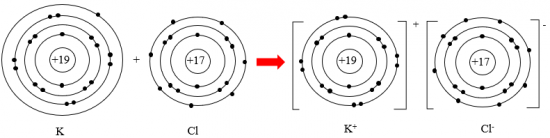
Câu 2: Quan sát Hình 6.2, em hãy mô tả sự tạo thành ion sodium, ion magnesium. Nhận xét về số electron lớp ngoài cùng của các ion này và cho biết sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm nào?
Trả lời rút gọn:
Nguyên tử sodium nhường 1 electron lớp ngoài cùng, nguyên tử magnesium nhường 2 electron lớp ngoài cùng, và tạo thành ion dương tương ứng.
Số electron lớp ngoài cùng của các ion này đểu là 8 electron.
Sự phân bố electron của 2 ion này giống với Ne.
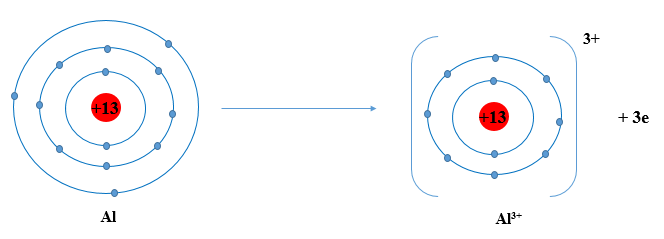
Luyện tập: Hãy xác định vị trí của alumnium trong bảng tuần hoàn và vẽ sơ đồ tạo thành ion alumnium từ nguyên tử alumnium.
Trả lời rút gọn:
Alumnium: ô số 13, nhóm IIIA, chu kì 3.
Sơ đồ:
Câu 3: Quan sát Hình 6.3, em hãy mô tả sự tạo thành ion chloride, ion oxide. Nhận xét về số electron lớp ngoài cùng của các ion này và cho biết sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm nào?
Trả lời rút gọn:
Nguyên tử chloride nhận 1 electron từ nguyên tử kim loại, nguyên tử oxide nhận 2 electron từ nguyên tử kim loại, và tạo thành ion âm tương ứng.
Số electron lớp ngoài cùng của các ion này đểu là 8 electron.
Sự phân bố electron của ion chloride giống với Ar, sự phân bố electron của ion oxide giống với Ne.
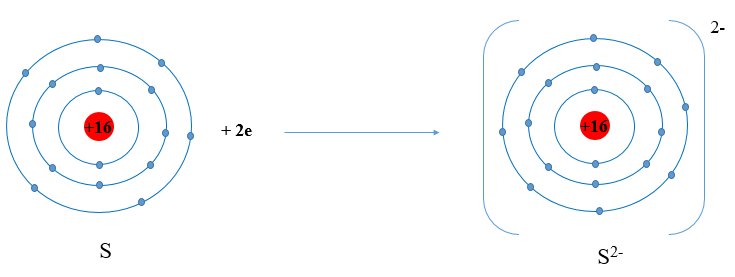
Luyện tập: Xác định vị trí của sunfur trong bảng tuần hoàn và vẽ sơ đồ tạo thành ion sunfur (S2-) từ nguyên tử sunfur.
Trả lời rút gọn:
Sunfur: ô số 16, nhóm VIA, chu kì 3.
Sơ đồ:
Câu 4: Quan sát Hình 6.4a, em hãy mô tả quá trình tạo thành liên kết ion trong phân tử sodium chloride. Nêu một số ứng dụng của sodium chloride trong đời sống.
Trả lời rút gọn:
Sodium + chlorine sẽ nhường 1 electron tạo thành ion dương, nguyên tử chlorine nhận 1 electron tạo thành ion âm. Ion dương và ion âm mang điện tích trái dấu hút nhau ® liên kết ion trong phân tử sodium chloride.
Ứng dụng của sodium chloride:
Trong công nghiệp: sản xuất giấy, thuốc nhuộm, dệt may, xà phòng, chất tẩy rửa.
Trong nông nghiệp, chăn nuôi: cân bằng sinh lý trong cơ thể giúp gia súc, gia cầm giảm bệnh tật.
Trong thực phẩm: bảo quản và khử mùi thực phẩm,
Trong y tế: sát trùng, thanh lọc cơ thể, làm đẹp da, trắng răng,...
Trong đời sống gia đình: rửa sạch ống thoát, tẩy rửa vết bẩn, vết ố,…
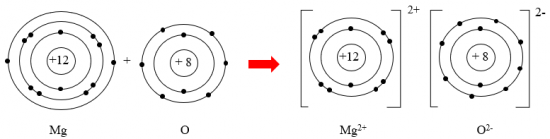
Luyện tập: Hãy vẽ sơ đồ mô tả quá trình tạo thành liên kết ion trong phân tử hợp chất magnesium oxide.
Trả lời rút gọn:
Vận dụng : Cancium chloride có nhiều ứng dụng trong đời sống. Tìm hiểu qua sách báo và internet em hãy cho biết một số ứng dụng của chất này . Vẽ sơ đồ cấu tạo trong phân tử cancium chloride
Trả lời rút gọn:
Ứng dụng: bào chế thuốc tiêm điều trị bệnh tĩnh mạch, bảo vệ cơ tim khi bị tăng kali máu, tránh các cơn đau tim cấp tính, bảo vệ và giúp tim nhanh phục hồi sau phẫu thuật; làm phụ gia thực phẩm; là chất điện giải trong một số nước uống…
3. LIÊN KẾT CỘNG HOÁ TRỊ
Câu 5: Dựa vào bảng tuần hoàn, hãy chỉ ra nguyên tố khí hiếm gần nhất của hydrogen và oxygen. Để có lớp electron ngoài cùng giống nguyên tố khí hiếm gần nhất, nguyên tử hydrogen và oxygen có xu hướng gì?
Trả lời rút gọn:
Nguyên tố khí hiếm gần nhất của hydrogen là helium, nguyên tố khí hiếm gần nhất của oxygen là neon.
Nguyên tử hydrogen và oxygen có xu hướng góp chung electron.
Câu 6: Dựa vào các Hình 6.5, 6.6 và 6.7, em hãy cho biết số electron lớp ngoài cùng của mỗi nguyên tử trong phân tử hydrogen và oxygen là bao nhiêu? Khi đó, lớp electron ngoài cùng của nguyên tử hydrogen và nguyên tử oxygen sẽ giống với khí hiếm nào?
Trả lời rút gọn:
Mỗi nguyên tử trong phân tử hydrogen có 2 electron lớp ngoài cùng giống với helium. Mỗi nguyên tử trong phân tử oxygen có 8 electron lớp ngoài cùng giống với neon.
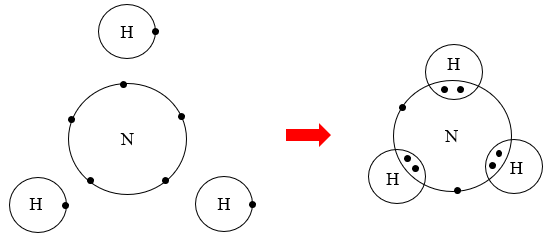
Câu 7: Em hãy mô tả quá trình tạo thành liên kết cộng hoá trị trong phân tử hydrogen và oxygen.
Trả lời rút gọn:
Phân tử hydrogen: hai nguyên tử hydrogen có xu hướng góp chung 1 electron của mỗi nguyên tử để hình thành liên kết cộng hoá trị.
Phân tử pxygen: hai nguyên tử oxygen có xu hướng góp chung 2 electron của mỗi nguyên tử để hình thành liên kết cộng hoá trị.
Câu 8: Quan sát Hình 6.8, em hãy cho biết số electron dùng chung của nguyên tử H và nguyên tử O. Trong phân tử nước, số electron lớp ngoài cùng của O và H là bao nhiêu và giống với khí hiếm nào?
Trả lời rút gọn:
H có 2 electron dùng chung, O có 4 electron dùng chung.
Trong phân tử nước, số electron lớp ngoài cùng của H là 2 giống helium, số electron lớp ngoài cùng của O là 8 giống neon.
Câu 9: Em hãy mô tả quá trình tạo thành liên kết cộng quá trị trong phân tử nước.
Trả lời rút gọn:
Hai nguyên tử hydrogen gộp chung 1 electron của mỗi nguyên tử với nguyên tử oxygen để hình thành liên kết cộng hoá trị. Nguyên tử oxygen cũng gộp 2 electron cho mỗi nguyên tử hydrgen để hình thành liên kết cộng hoá trị.
Vận dụng : Khí methane là thành phần chính của khí thiên nhiên và khí mỏ dầu. Khí này còn được tạo ra từ hầm biogas. Methane là nguồn nhiên liệu quan trọng trong đời sống và có nhiều ứng dụng trong công nghiệp . Hãy vẽ sơ đồ hình thành liên kết trong phân tử methane và liệt kê một số ứng dụng của của nó thông qua tìm hiểu mạng internet, báo, đài...
Luyện tập: Vẽ sơ đồ hình thành liên kết cộng hoá trị trong các phân tử sau:
Trả lời rút gọn:
Ứng dụng: nhiên liệu, khí tự nhiên, khí tự nhiên hóa lỏng và được vận chuyển dưới dạng chất lỏng được làm lạnh.
Sơ đồ:
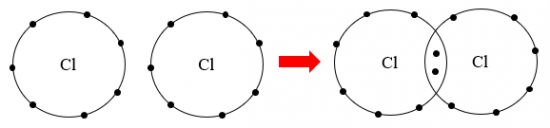
4. CHẤT ION, CHẤT CỘNG HOÁ TRỊ
Câu 10: Cho biết mỗi phân tử của chất trong Hình 6.9 được tạo bởi các ion nào? Ở điều kiện thường, các chất này ở thể gì?
Trả lời rút gọn:
Phân tử sodium chloride được tạo thành bởi ion Na+ và Cl- => thể rắn.
Phân tử calcium chloride được tạo thành bởi ion Ca2+ và Cl- => thể rắn.
Phân tử magnesium oxide được tạo thành bởi ion Mg2+ và O2- => thể rắn.
Câu 11: Quan sát và cho biết thể của các chất có trong Hình 6.10.
Trả lời rút gọn:
Đường tinh luyện ở thể rắn, ethanol ở thể lỏng, carbon dioxide ở thể khí.
Câu 12: Nếu một số ví dụ về chất cộng hoá trị và cho biết thể của chúng ở điều kiện thường.
Trả lời rút gọn:
Ví dụ: Nước ở thể lỏng, chlorine ở thể khí.
Khói của núi lửa ngầm phun trào dưới biển có chứa một số chất như: hơi nước, sodium chloride, carbon dioxide, sulfur dioxide.
a) Hãy cho biết chất nào là hợp chất ion, chất nào là hợp chất hoá trị?
b) Nguyên tử của nguyên tố nào trong các chất trên có số electron lớp ngoài cùng nhiều nhất?
Trả lời rút gọn:
a)
Hợp chất ion: sodium chloride, potassium chloride.
Hợp chất hoá trị: hơi nước, carbon dioxide, sulfur dioxide.
b) Nguyên tử của nguyên tố chlorine có electron lớp ngoài cùng nhiều nhất.
5. MỘT SỐ TÍNH CHẤT CỦA CHẤT ION VÀ CHẤT CỘNG HOÁ TRỊ
Câu 13: Quan sát thí nghiệm 1 (Hình 6.11, 6.12) và đánh dấu V để hoàn thành bảng sau:
Trả lời rút gọn:
Tính chất | Muối | Đường |
Tan trong nước | V | V |
Dẫn điện được | V |
Câu 14: Quan sát thí nghiệm 3 (Hình 6.13), cho biết muối hay đường bền nhiệt hơn. Ở ống nghiệm nào có sự tạo thành chất mới?
Trả lời rút gọn:
Nhận xét: muối bền nhiệt hơn đường, ở ống nghiệm của đường có sự tạo thành chất mới.
Luyện tập: Kết quả thứ nghiệm tính chất của 2 chất A và B được trình bày ở bảng bên. Em hãy cho biết chất nào là chất cộng hoá trị, chất nào là chất ion?
Trả lời rút gọn:
Chất A là chất ion, chất B là chất hoá trị.
Vận dụng : Khi cơ thể bị mất nước do tiêu chảy, nôn mửa,... người ta thường cho bệnh nhân uống dung dịch oresol. Tìm hiểu qua sách báo và internet, hãy cho biết thành phần của oresol có các loại chất nào (chất ion, chất cộng hóa trị). Trong trường hợp không có oresol, có thể thay bằng cách nào khác không ? Giải thích.
Trả lời rút gọn:
Thành phần của oresol là muối và đường. Trong trường hợp không có oresol, có thể thay bằng nước chanh muối pha loãng.
BÀI TẬP
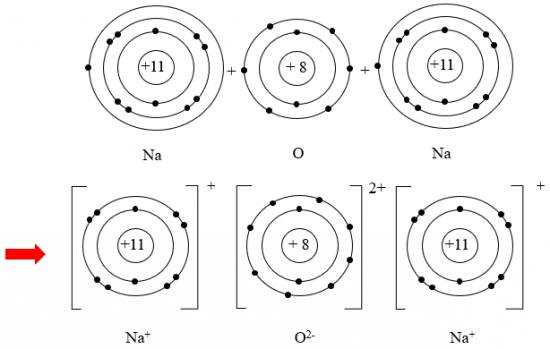
Câu 1: Hãy vẽ sơ đồ và mô tả quá trình tạo thành liên kế trong phân tử sodium oxide (hình bên).
Trả lời rút gọn:
Câu 2: Cho biết vị trí trong bảng tuần hoàn, số electron lớp ngoài cùng của nguyên tử mỗi nguyên tố N, C, O và vẽ sơ đồ hình thành liên kết trong các phân tử ở hình sau:
Trả lời rút gọn:
Kí hiệu hoá học | Ô nguyên tố | Chu kì | Nhóm | Số e lớp ngoài cùng |
N | 7 | 2 | VA | 5 |
C | 6 | 2 | IVA | 4 |
O | 8 | 2 | VIA | 6 |
Sơ đồ hình thành liên kết trong phân tử nitrogen:
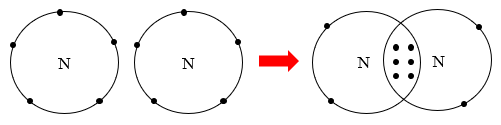
Sơ đồ hình thành liên kết trong phân tử carbon dioxide:
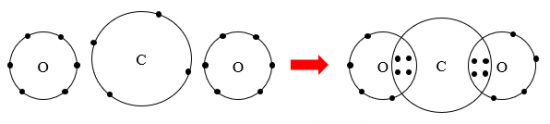
Câu 3: Potassium chloride là hợp chất có nhiều ứng dụng trong đời sống. Trong nông nghiệp, nó được dùng làm phân bón. Trong công nghiệp, potassium chloride được dùng làm nguyên liệu để sản xuất potassium hydroxide và kim loại potassium. Trong y học, potassium chloride được dùng để bào chế thuốc điều trị bệnh thiếu kali trong máu. Potassium chloride rất cần thiết cho cơ thể, trong các chức năng hoạt động của hệ tiêu hoá, tim, thận, cơ và cả hệ thần kinh. Hợp chất potassium chloride có loại liên kết gì trong phân tử? Vẽ sơ đồ hình thành liên kết có trong phân tử này.
Trả lời rút gọn:
Hợp chất potassium chloride có loại liên kết ion trong phân tử.
Sơ đồ: