Slide bài giảng Hoá học 11 cánh diều Bài 7: Sulfuric acid và muối sulfate
Slide điện tử Bài 7: Sulfuric acid và muối sulfate. Trình bày với các hiệu ứng hiện đại, hấp dẫn. Giúp học sinh hứng thú học bài. Học nhanh, nhớ lâu. Có tài liệu này, hiệu quả học tập của môn Hóa học 11 Cánh diều sẽ khác biệt
Bạn chưa đủ điều kiện để xem được slide bài này. => Xem slide bài mẫu
Tóm lược nội dung
CHỦ ĐỀ 2. NITROGEN VÀ SULFUR
BÀI 7: SULFURIC ACID VÀ MUỐI SULFATE
KHỞI ĐỘNG
GV yêu cầu HS thảo luận và trả lời: Nhãn dán trên chai đựng dung dịch sulfuric acid thường có hình như Hình 7.1. Giải thích ý nghĩa của hình và nguyên nhân gây nên hiện tượng được mô tả trong hình.
NỘI DUNG BÀI HỌC GỒM
- SUNFURIC ACID
- Cấu tạo phân tử và tính chất vật lí
- Tính chất hóa học
- Bảo quản và xử lí bỏng sulfuric acid
- Ứng dụng và sản xuất sulfuric acid
- MUỐI SULFATE
- Một số muối sulfate
- Nhận biết ion SO42- trong dung dịch
- Một số biện pháp làm giảm phát thải sulfur dioxide vào khí quyển
HÌNH THÀNH KIẾN THỨC
I. SUNFURIC ACID
1. Cấu tạo phân tử và tính chất vật lí
- Hãy cho biết cấu tạo phân tử H2SO4?
- Phân tử H2SO4 có tính chất vật lí gì?
Nội dung ghi nhớ:
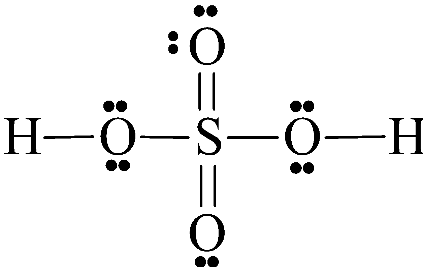
- Sulfuric acid là chất lỏng sánh như dầu, không màu, không bay hơi.
- Dung dịch sulfuric acid đặc có khả năng hút ẩm nên thường được dùng để làm khô hóa chất.
- Sulfuric acid tan tốt trong nước; quá trình hòa tan tỏa ra một lượng nhiệt lớn.
2. Tính chất hóa học
- Trong thí nghiệm 1 có hiện tượng gì? Viết phương trình hoá học minh hoạ và xác định vai trò của mỗi chất phản ứng?
- Sulfuric acid có những tính chất gì?
- Số oxi hóa lớn nhất cua sulfur trong các hợp chất là +6. Vậy H2SO4 có khả năng thể hiện tính khử không? Giải thích.
- Sulfuric acid có tính oxi hóa mạn như thế nào? Khi cho dung dịch sulfuric acid đặc tắc dụng với S và KBr, em hãy viết phương trình hoá học?
- Trong thí nghiệm 2 có hiện tượng gì. Giải thích và viết phương trình hoá học.
Nội dung ghi nhớ:
Thí nghiệm 1. Tính oxi hóa của dung dịch sulfuric acid loãng và dung dịch sulfuric acid đặc
Hiện tượng:
- Ống nghiệm 1: Không thấy xuất hiện hiện tượng gì
- Ống nghiệm 2: Mảnh đồng tan dần, có khí không màu thoát ra, sau phản ứng thu được dung dịch có màu xanh
Phương trình hóa học:
![]()
- H2SO4 đóng vai trò là chất oxi hóa
- Cu đóng vai trò là chất khử
* Tính chất hóa học của dung dịch sulfuric acid
Dung dịch sulfuric acid loãng có các tính chất chung của một acid:
- Đổi màu quỳ tím thành đỏ
- Tác dụng với những kim loại hoạt động trong dãy hoạt động hóa học
- Tác dụng với oxide base và base
- Tác dụng với nhiều muối
Trong hợp chất H2SO4, sulfur có số oxi hóa là +6, đây là số oxi hóa cao nhất của sulfur do đó H2SO4 không thể hiện tính khử
* Tính chất hóa học của dung dịch sulfuric acid đặc
Tính oxi hóa mạnh
Dung dịch sulfuric acid đặc có tính oxi hóa rất mạnh; oxi hóa được hầu hết các kim loại (trừ vàng, platinum); nhiều phi kim và hợp chất
Ví dụ:
![]()
![]()
Tính háo nước
Thí nghiệm 2. Tính háo nước và tính oxi hóa của dung dịch sulfuric acid đặc
- Hiện tượng: Đường kính hoặc bột gạo hay bột mì dần dần hóa than, có hiện tượng sủi bọt đẩy C trào ra ngoài cốc
- Giải thích: Các hợp chất dạng Cn(H2O)m bị than hóa do phản ứng tạo ra carbon. Một phần carbon sẽ tiếp tục bị oxi hóa bởi acid tạo thành khí, đẩy C trào ra ngoài
- Phương trình hóa học:
Cn(H2O)m(s) ![]() nC(s) + mH2O(l)
nC(s) + mH2O(l)
C(s) + 2H2SO4(aq) ![]() CO2(g) + 2SO2(g) + 2H2O(l)
CO2(g) + 2SO2(g) + 2H2O(l)
3. Bảo quản và xử lí bỏng sulfuric acid
- Sulfuric acid được bảo quản như thế nào?
- Khi sử dụng sulfuric acid, chúng ta cần tuôn thủ những nguyên tắc đảm bảo an toàn nào?
- Cần sơ cứu như thế nào khi bị bỏng sulfuric acid?
Nội dung ghi nhớ:
- Bảo quản ở nơi ít có nguy cơ bị va chạm, xa nguồn nhiệt và các hóa chất khác.
- Khi sử dụng với sulfuric acid, sử dụng các dụng cụ bảo hộ như áo bảo hộ, kính bảo hộ, găng tay chống thấm,...
- Sơ cứu khi bị bỏng bởi sulfuric acid:
+ Rửa sạch vết bỏng dưới vòi nước sạch trong ít nhất 20 phút
+ Tuyệt đối không chườm đá lạnh, không xoa vết bỏng bằng các loại kem, gel, dầu,...
4. Ứng dụng và sản xuất sulfuric acid
- Sulfuric acid có những ứng dụng gì?
- Viết các phương trình thể hiện các giai đoạn trong quá trình sản xuất sulfuric acid theo phương pháp tiếp xúc
- Hãy cho biết ý kiến của em với phát biểu sau: ‘Nhờ có chất xúc tác nên phản ứng giữa SO2 và O2 ưu tiên diễn ra theo chiều thuận’’. Giải thích?
Nội dung ghi nhớ:
- Ứng dụng:
+ Sản xuất phân bón như ammonium, sulfate, calcium dihydrogenphosphate (Ca(H2PO4)2),...
+ Sản xuất chất tẩy rửa, sơn, phẩm màu, thuốc trừ sâu, giấy, chế hóa dầu mỏ,...
- Sản xuất sulfuric acid bằng phương pháp tiếp xúc:

- Phát biểu trên là sai. Do chất xúc tác làm tăng tốc độ phản ứng thuận và tốc độ phản ứng nghịch với số lần bằng nhau, do đó chất xúc tác không làm cân bằng
II. MUỐI SULFATE
1. Một số muối sulfate
- Muối sulfate là gì?
- Em đã biết những muối sulfate phổ biến nào rồi, hãy kể tên và cho biết các ứng dụng của chúng trong cuộc sống.
Nội dung ghi nhớ:
- Muối sulfate là hợp chất có chứa ion sulfate (SO42-)
- Một số muối sulfate phổ biến cùng các ứng dụng của chúng trong cuộc sống:
+ Ammonium sulfate ((NH4)2SO4): dùng làm phân bón cung cấp đạm cho đất
+ Magnesium sulfate (MgSO4): làm phân bón; thuốc cung cấp magnesium cho cơ thể; chất hút ẩm, chất hút mồ hôi tay của vận động viên thể dục dụng cụ,...
+ Calcium sulfate dihydrate (CaSO4.2H2O): Thành phần chính của thạch nung cao, vật liệu xây dựng, nặn đúc tượng và khuôn đúc, bó chỉnh hình trong y học; chất phụ gia; hạn chế hiện tượng nhão của bột trong làm bánh; giữ nước bên trong các loại mứt;...
+ Barium sulfate (BaSO4): Sử dụng rộng rãi trong các lĩnh vực như sơn, mực in, lớp phủ, men, sản xuất các loại giấy trắng chất lượng cao; thành phần chính của thuốc cản quang trong chụp X-quang
2. Nhận biết ion SO42- trong dung dịch
HS thảo luận trả lời câu hỏi:
- Làm thế nào để nhận biết ion SO42- trong dung dịch?
Nội dung ghi nhớ:
Để nhận biết sự có mặt của ion sulfate (SO42- ) trong dung dịch, người ta thường sử dụng dung dịch muối của Ba2+, làm xuất hiện kết tủa màu trắng của barium sulfate:
Ba2+(aq) + SO42- (aq) ![]() BaSO4(s)
BaSO4(s)
C. HOẠT ĐỘNG LUYỆN TẬP
- Hoàn thành bài tập trắc nghiệm sau:
Câu 1: Cho FeCO3 tác dụng với H2SO4 đặc nóng, sản phẩm khí thu được gồm có:
A. H2S và CO2
B. CO2 và SO2
C. CO2
D. SO2
Câu 2: Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là:
A. Ag, Ba, Fe, Sn
B. K, Mg, Al, Fe, Zn
C. Au, Pt
D. Cu, Zn, Na, Ba
Câu 3: Khi cho Fe2O3 tác dụng với H2SO4 đặc nóng thì sản phẩm thu được là:
A. Fe2(SO4)3 và H2O
B. Fe2(SO4)3; SO2 và H2O
C. FeSO4; SO2 và H2O
D. FeSO4 và H2O
Câu 4: Để nhận biết sự có măt của ion sunfat trong dung dịch, người ta thường dùng
A. quỳ tím
B. thuốc thử duy nhất là Ba(OH)2
C. dung dịch chứa ion Ba2+
D. dung dịch muối Mg2+
Câu 5: Dùng 300 tấn quặng pirit (FeS2) có lẫn 20% tạp chất để sản xuất acid H2SO4 có nồng độ 98%. Biết rằng hiệu suất phản ứng là 90%. Khối lượng acid H2SO4 98% thu được là
A. 320 tấn
B. 335 tấn
C. 350 tấn
D. 360 tấn
Gợi ý đáp án:
| Câu | 1 | 2 | 3 | 4 | 5 |
| Đáp án | B | B | A | C | D |
D. HOẠT ĐỘNG VẬN DỤNG
Vận dụng kiến thức, GV yêu cầu HS trả lời câu hỏi:
Câu 1: Hòa tan 3,22 gam hỗn hợp X gồm Fe, Mg và Zn bằng một lượng vừa đủ dung dịch H2SO4 loãng, thu được 1,344 lít khí hiđro ở đktc và dung dịch chứa m gam muối. Hãy tìm giá trị của m
Câu 2: Cho 2,81 gam hỗn hợp gồm 3 oxit Fe2O3, MgO, ZnO tan vừa đủ trong 300ml dung dịch H2SO4 0,1M thì khối lượng muối sunfat khan tạo thành là bao nhiêu?
