Slide bài giảng Hoá học 11 cánh diều Bài 6: Sulfur và sulfur dioxide
Slide điện tử Bài 6: Sulfur và sulfur dioxide. Trình bày với các hiệu ứng hiện đại, hấp dẫn. Giúp học sinh hứng thú học bài. Học nhanh, nhớ lâu. Có tài liệu này, hiệu quả học tập của môn Hóa học 11 Cánh diều sẽ khác biệt
Bạn chưa đủ điều kiện để xem được slide bài này. => Xem slide bài mẫu
Tóm lược nội dung
CHỦ ĐỀ 2. NITROGEN VÀ SULFUR
BÀI 6: SULFUR VÀ SULFUR DIOXIDE
KHỞI ĐỘNG
GV yêu cầu HS thảo luận và trả lời: Theo em việc lạm dụng sulfur để bảo quản dược liệu, thực phẩm khô,... có thể gây hại đến sức khỏe. Giải thích?
NỘI DUNG BÀI HỌC GỒM
- SULFUR
- Trạng thái tự nhiên
- Tính chất
- Ứng dụng
- SULFUR DIOXIDE
- Một số tính chất
- Ứng dụng
- Một số biện pháp làm giảm phát thải sulfur dioxide vào khí quyển
HÌNH THÀNH KIẾN THỨC
I. SULFUR
1. Trạng thái tự nhiên
- Nguyên tử sulfur có kí hiệu hoá học, số hiệu như thế nào?
- Sulfur tồn tại ở dạng nào trong tự nhiên?
Nội dung ghi nhớ:
- Sulfur có kí hiệu hóa học là S, số hiệu nguyên tử là 16
- Trong tự nhiên, sulfur tồn tại ở cả dạng đơn chất và hợp chất.
Hoạt động 2: Tính chất
* Tính chất vật lí
- Đơn chất sulfur là chất gì ở điều kiện thường và nó có màu gì?
- Trong nước, ethanol, dầu hỏa, benzene thì độ tan của sulfur là như thế nào?
* Tính chất hoá học
- Phân tử của sulfur có cấu tạo như thế nào?
- Sulfur thể hiện tính chất gì khi tham gia phản ứng hóa học?
* Tính oxi hoá và tính khử:
- Em hãy làm sáng tỏ sulfur đơn chất vừa có tính oxi hoá (tác dụng với kim loại), vừa có tính khử (tác dụng với oxy gen)
Nội dung ghi nhớ:
* Tính chất vật lí
- Ở điều kiện thường, đơn chất sulfur là chất rắn, màu vàng, không tan trong nước, tan ít trong ethanol, tan nhiều trong dầu hỏa, benzene.
* Tính chất hóa học
- Ở điều kiện thường, phân tử đơn chất sulfur gồm 8 nguyên tử S.
- Khi tham gia phản ứng hóa học, sulfur thể hiện tính oxi hóa hoặc tính khử
* Tính oxi hóa
- Sulfur phản ứng với nhiều kim loại, với hydrogen tạo ra các hợp chất sulfide
Ví dụ:
![]()
- Sulfur phản ứng với thủy ngân (mercury) ngay ở nhiệt độ thường:
![]()
⟹ Có thể dùng sulfur để loại bỏ thủy phân rơi vãi khi nhiệt kế thủy ngân bị vỡ
Trong các phản ứng trên, số oxi hóa của sulfur giảm từ 0 xuống –2.
* Tính khử
- Ở nhiệt độ thích hợp, sulfur phản ứng với một số phi kim như oxygen, chlorine, fluorine. Trong các phản ứng đó, số oxi hóa của sulfur tăng
- Ví dụ:
![]()
Hoạt động 3: Ứng dụng
- Sulfur có ứng dụng gì?
Nội dung ghi nhớ:
- Sản xuất sulfuric acid, dược phẩm, phẩn nhuộm, thuốc trừ sâu
- Lưu hóa cao su
- Diệt vi khuẩn và nấm mốc
II. SULFUR DIOXIDE
1. Một số tính chất
- Sulfur dioxide có những tính chất gì? Nêu ví dụ cụ thể.
Nội dung ghi nhớ:
- Ở điều kiện thường, sulfur dioxide (SO2) là chất khí không màu, có mùi hắc, độc và tan nhiều trong nước.
- Sulfur dioxide thể hiện các tính chất của một oxide acid
- Sulfur còn thể hiện cả tính oxi hóa và tính khử
- Ví dụ:
![]()
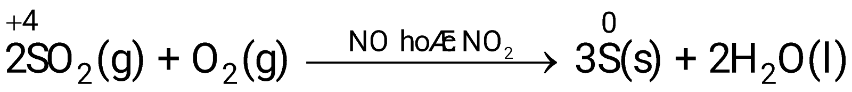
2. Ứng dụng
- Sulfur dioxide có những ứng dụng gì?
Nội dung ghi nhớ:
- Sulfur dioxide là chất trung gian quan trọng trong quá trình sản xuất sulfuric acid.
- Dùng để tẩy trắng vải sợi, đường; sản xuất thuốc trừ sâu và thuốc sát trùng.
3. Một số biện pháp làm giảm phát thải sulfur dioxide vào khí quyển
- Đối với môi trường và đối với con người, sulfur dioxide có tác hại gì?
- Nguồn gốc của Sulfur dioxide là từ đâu?
- Để giảm thiểu lượng sulfur dioxide vào không khí có những biện pháp nào?
Nội dung ghi nhơ:
*Tác hại
- Đối với môi trường, khí SO2 là nguyên nhân chủ yếu gây ra mưa acid.
- Đối với con người, khí SO2 tạo cảm giác khó thở, gây bệnh viêm đường hô hấp; khi vào cơ thể kết hợp với nước tạo acid làm giảm pH của máu.
*Nguồn phát sinh SO2:
- Núi lửa hoạt động
- Đốt cháy nhiên liệu
- Quá trình sản xuất sulfuric acid
*Biện pháp làm giảm sulfur dioxide:
- Thay thế dần các nhiên liệu hóa thạch bằng nhiên liệu thân thiện môi trường, kết hợp khai thác nguồn năng lượng tái tạo.
- Dẫn khí thải của các nhà máy vào tháp hoặc bồn chứa các chất hấp phụ phù hợp.
- Chuyển hóa sulfur dioxide thành các chất ít gây ô nhiễm hơn bằng các hóa chất như vôi sống, vôi tôi hoặc đá vôi nghiền.
C. HOẠT ĐỘNG LUYỆN TẬP
- Hoàn thành bài tập trắc nghiệm sau:
Câu 1: SO2 là một khí độc được thải ra từ các vùng công nghiệp, là một trong những nguyên nhân chính gây ra hiện tượng nào dưới đây?
A. Sương mù
B. Hiệu ứng nhà kính.
C. Hiệu ứng domino.
D. Mưa acid.
Câu 2: Tính chất vật lí nào sau đây không phải của sulfur?
A. Có tnc thấp hơn ts của nước
B. Không tan trong nước
C. Chất rắn màu vàng, giòn
D. Có nhiều dạng thù hình
Câu 3: Nguyên tố sulfur có số hiệu nguyên tử là 16. Vị trí của sulfur trong bảng tuần hoàn các nguyên tố hóa học là
A. chu kì 3, nhóm IVA.
B. chu kì 5, nhóm VIA.
C. chu kì 3, nhóm VIA.
D. chu kì 5, nhóm IVA.
Câu 4: Cho phản ứng: SO2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4.
Trong phương trình hóa học của phản ứng trên, khi hệ số của KMnO4 là 2 thì hệ số của SO2 là
A. 4.
B. 7.
C. 6.
D. 5.
Câu 5: Nhận định nào sau đây phản ánh đúng tính chất hóa học của sulfur?
A. Sulfur có tính oxy hóa
B. Sulfur có tính khử
C. Sulfur vừa có tính khử vừa có tính oxy hóa
D. Sulfur không có tính khử và tính oxy hóa
Gợi ý đáp án:
| Câu | 1 | 2 | 3 | 4 | 5 |
| Đáp án | D | A | C | D | C |
D. HOẠT ĐỘNG VẬN DỤNG
Vận dụng kiến thức, GV yêu cầu HS trả lời câu hỏi:
Câu 1: Khi nung nóng hỗn hợp bột gồm 9,6 gam Sulfur và 22,4 gam Iron trong ống nghiệm kín, không chứa không khí, sau khi phản ứng hoàn toàn thu được rắn Y. Em hãy cho biết thành phần của rắn Y?
Câu 2: Hãy xác định khi sX biết chất khí X tan trong nước tạo ra một dung dịch làm chuyển màu quỳ tím thành đỏ và có thể được dùng làm chất tẩy màu?
