Soạn giáo án hóa học 10 cánh diều bài 4: Mô hình nguyên tử và orbital nguyên tử
Giáo án powerpoint hóa học 10 Cánh diều mới bài bài 4: Mô hình nguyên tử và orbital nguyên tử. Giáo án soạn theo tiêu chí hiện đại, đẹp mắt với nhiều hình ảnh, nội dung, hoạt động phong phú, sáng tạo. Giáo án điện tử này dùng để giảng dạy online hoặc trình chiếu. Tin rằng, bộ bài giảng này sẽ hỗ trợ tốt việc giảng dạy và đem đến sự hài lòng với thầy cô.











Còn nữa....Giáo án khi tải về là bản đầy đủ. Có full siles bài giảng!
Nội dung giáo án
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC MỚI
- Trong lịch sử các thuyết về mô hình nguyên tử và mô hình hiện đại nguyên tử. Theo em, trong hai hình bên, hình nào thể hiện mô hình hành tinh nguyên tử, hình nào thể hiện mô hình hiện đại của nguyên tử?
BÀI 4: MÔ HÌNH NGUYÊN TỬ VÀ ORBITAL NGUYÊN TỬ
NỘI DUNG BÀI HỌC
Mô hình nguyên tử
Orbital nguyên tử
- Mô hình nguyên tử
- Mô hình Rutherford – Borh
Trình bày nội dung chính mô hình nguyên tử của Rutherford – Borh.
- Khối lượng nguyên tử được tính như thế nào?
- Trong nguyên tử các electron chuyển động theo quỹ đạo như thế nào?
- Năng lượng của electron phụ thuộc vào yếu tố nào?
Câu trả lời:
(1) Khối lượng nguyên tử tập trung chủ yếu ở hạt nhân
(2) Electron quay xung quanh hạt nhân tròn như các hành tinh cung quanh mặt trời.
(3) Năng lượng của electron phụ thuộc vào khoảng cách từ electron đó tới hạt nhân nguyên tử. Electron ở càng xa hạt nhân thì có năng lượng càng cao.
Câu 1: Electron chuyển từ lớp gần hạt nhân ra lớp xa hạt nhân thì phải thu hay phóng năng lượng? Giải thích.
Câu trả lời:
Electron chuyển từ lớp gần hạt nhân ra lớp xa hạt nhân thì phải thu năng lượng. Vì năng lượng của electron phụ thuộc vào khoảng cách của electron đó tới hạt nhân nguyên tử.
Sử dụng Hình 4.2, trình bày cách sắp xếp các electron trong các lớp.
Kí hiệu tên các lớp là gì? Số electron tối đa trong mỗi lớp là bao nhiêu?
Quan sát hình 4.2, theo chiều từ hạt nhân ra ngoài lớp vỏ, electron được sắp xếp vào các lớp:
Nhận xét:
Các electron được phân bố vào lớp gần hạt nhân trước. Số electron tối đa trong mỗi lớp là 2n2, với n là số thứ tự lớp electron (n ≤ 4)
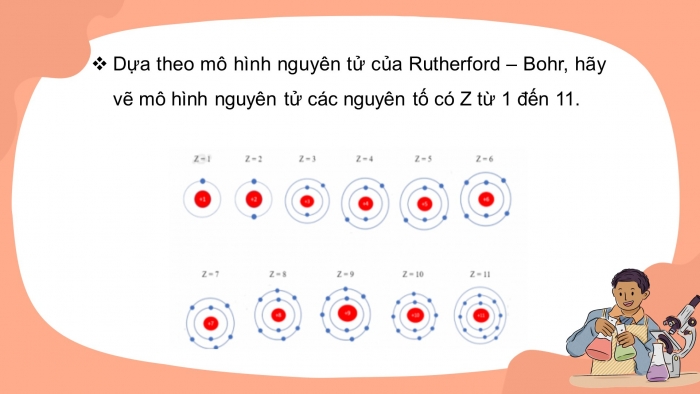
- Dựa theo mô hình nguyên tử của Rutherford – Bohr, hãy vẽ mô hình nguyên tử các nguyên tố có Z từ 1 đến 11.
- Mô hình hiện đại về nguyên tử
(1) Sự khác biệt cơ bản của mô hình hiện đại với mô hình Rutherford là gì? Lập bảng so sánh hai mô hình này.
(2) Trong mô hình này các electron chuyển động như thế nào?
(3) Xác suất tìm thấy electron trong các đám mây electron ở hình 4.3 khoảng bao nhiêu phần trăm?
(1) Sự khác biệt cơ bản của mô hình hiện đại với mô hình Rutherford – Bohr là các electron chuyển động xung quanh hạt nhân không theo những quỹ đạo xác định.
(2) Electron chuyển động xung quanh hạt nhân rất nhanh trong cả khu vực không gian xung quanh hạt nhân với xác suất tìm thấy khác nhau, sự chuyển động này tạo nên một hình ảnh như một đám mây electron.
(3) Xác suất tìm thấy electron ở hình 4.3 là khoảng 90%.
Câu 2: Theo em, xác suất tìm thấy electron trong toàn phần không gian bên ngoài đám mây là khoảng bao nhiêu phần trăm?
Câu trả lời:
Xác suất tìm thấy electron trong toàn phần không gian bên ngoài là khoảng 10%
- Orbttal nguyên tử
- Khái niệm
Trình bày nội dung chính mô hình nguyên tử của Rutherford – Borh.
- Nêu khái niệm orbital. Kí hiệu AO được viết tắt của từ tiếng anh nào?
- Câu trả lời:
- Orbital nguyên tử là khu vực không gian xung quanh hạt nhân mà xác suất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%). Orbital nguyên tử kí hiệu là AO ( viết tắt của: Atomic Orbital)
Quan sát hình 4.3, miêu tả orbital nguyên tử hydrogen.
Câu trả lời:
Orbital nguyên tử hydrogen có hình tròn
Giáo án điện tử hóa học 10 Cánh diều, giáo án powerpoint hóa học 10 Cánh diều bài 4: Mô hình nguyên tử và orbital, bài giảng điện tử hóa học 10 Cánh diều
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
