Soạn giáo án hóa học 10 cánh diều bài 10: Liên kết ion
Giáo án powerpoint hóa học 10 Cánh diều mới bài bài 10: Liên kết ion. Giáo án soạn theo tiêu chí hiện đại, đẹp mắt với nhiều hình ảnh, nội dung, hoạt động phong phú, sáng tạo. Giáo án điện tử này dùng để giảng dạy online hoặc trình chiếu. Tin rằng, bộ bài giảng này sẽ hỗ trợ tốt việc giảng dạy và đem đến sự hài lòng với thầy cô.









Còn nữa....Giáo án khi tải về là bản đầy đủ. Có full siles bài giảng!
Nội dung giáo án
CHÀO MỪNG CÁC EM ĐẾN VỚI TIẾT HỌC HÔM NAY
Theo dõi video sau và trả lời câu hỏi:
Nguyên tử Sodium và Fluorine muốn đạt được cấu hình electron bền vững như Neon thì chúng phải làm thế nào và trong phân tử sodium fluoride (có trong kem đánh răng) hình thành liên kết gì?
BÀI 10: LIÊN KẾT ION
NỘI DUNG BÀI HỌC
- Khái niệm và sự hình thành liên kết ion
- Tinh thể ion
- Khái niệm và sự hình thành liên kết ion
Hoạt động nhóm chuyên gia hoàn thành phiếu học tập
Nhóm 1, 3
Nghiên cứu phiếu học tập nhóm A.
Nhóm 2, 4
Nghiên cứu phiếu học tập nhóm B.
Hoạt động nhóm mảnh ghép hoàn thành phiếu học tập C
Đáp án
Nhóm A
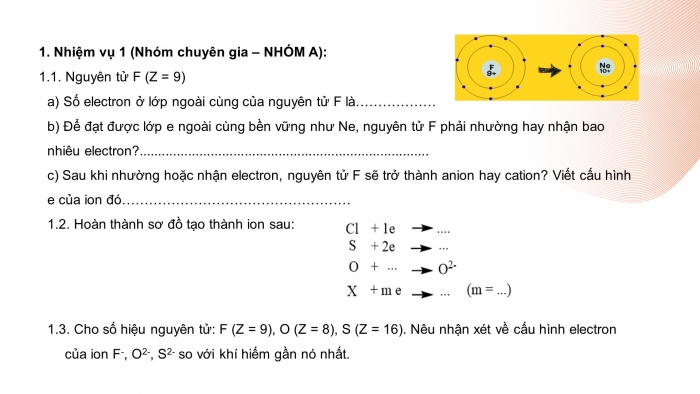
1.1. Nguyên tử F (Z = 9)
- a) Số electron ở lớp ngoài cùng của nguyên tử F là 7.
- b) Để đạt được lớp e ngoài cùng bền vững như Ne, nguyên tử F phải nhận 1 electron.
- c) Sau khi nhận 1 electron, nguyên tử F sẽ trở thành anion.
Cấu hình e của ion đó: 1s22s22p6
1.2.
Nhóm B
1.1. Nguyên tử Na (Z = 11)
- a) Số electron ở lớp ngoài cùng của nguyên tử Na là 1.
- b) Để đạt được lớp e ngoài cùng bền vững như Ne, nguyên tử Na phải nhường 1 electron.
- c) Sau khi nhường electron, nguyên tử Na sẽ trở thành cation.
Cấu hình e của ion đó: 1s22s22p6
1.2.
(n=1,2,3)
1.3. Cấu hình electron của ion Na+, Mg2+, Al3+, K+ giống cấu hình electron của khí hiếm gần nó nhất.
3.1
- Na: 1s22s22p63s1 Na ® Na+ + 1e
- Cl: 1s22s22p63s23p5 Cl + 1e ® Cl-
- Các ion trái dấu hút nhau bằng lực hút tĩnh điện tạo nên hợp chất ion.
- Na+ + Cl– ® NaCl
3.2.
- Ion đơn nguyên tử: Na+, F-, Al3+, O2−, S2−.
- Ion đa nguyên tử: SO42−, OH-
3.3.
- Phân tử CaO
- Ca: 1s22s22p63s23p64s2 Ca ® Ca2+ + 2e
- Cl: 1s22s22p63s23p5 2Cl + 2.1e ® 2Cl-
- Các ion trái dấu hút nhau bằng lực hút tĩnh điện tạo nên hợp chất ion.
- Ca2+ + 2Cl- ® CaCl2
Hoạt động nhóm
- Nêu kết luận về:
- Quá trình hình thành các ion âm
- Quá trình hình thành các ion dương.
- Thế nào là ion đơn nguyên tử đa nguyên tử ?
- Khái niệm liên kết ion.
- Nêu các giai đoạn hình thành liên kết ion.
- Nguyên tử phi kim có xu hướng nhận thêm electron để trở thành ion âm hay anion (có cấu hình electron giống khí hiếm).
- Tổng quát:
X + m e → Xm-
- Nguyên tử kim loại có xu hướng nhường electron để trở thành ion dương hay cation (có cấu hình electron giống khí hiếm).
- Tổng quát:
M → Mn+ +ne
- Liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
- Sự hình thành liên kết ion:
- Giai đoạn 1: Hình thành các ion trái dấu từ các quá trình kim loại nhường electron và phi kim nhận electron theo quy tắc octet.
- Giai đoạn 2: Các ion trái dấu hút nhau bằng lực hút tĩnh điện tạo nên hợp chất ion. Các ion trái dấu kết hợp với nhau theo tỉ lệ sao cho tổng điện tích của các ion trong hợp chất phải bằng 0.
- Tinh thể ion
- Tinh thể ion là gì?
- Tinh thể ion là loại tinh thể được tạo nên bởi các cation và anion.
- Kể tên 1 số tinh thể mà em biết.
- Nêu đặc điểm của hợp chất ion ( vd NaCl) về tính tan trong nước, nhiệt độ nóng chảy và nhiệt độ sôi so với một số loại tinh thể khác (vd: than chì, nước đá,vv…)
Giáo án điện tử hóa học 10 Cánh diều, giáo án powerpoint hóa học 10 Cánh diều bài 10: Liên kết ion, bài giảng điện tử hóa học 10 Cánh diều
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
