Soạn giáo án hóa học 10 cánh diều bài 11: Liên kết cộng hóa trị
Giáo án powerpoint hóa học 10 Cánh diều mới bài bài 11: Liên kết cộng hóa trị. Giáo án soạn theo tiêu chí hiện đại, đẹp mắt với nhiều hình ảnh, nội dung, hoạt động phong phú, sáng tạo. Giáo án điện tử này dùng để giảng dạy online hoặc trình chiếu. Tin rằng, bộ bài giảng này sẽ hỗ trợ tốt việc giảng dạy và đem đến sự hài lòng với thầy cô.









Còn nữa....Giáo án khi tải về là bản đầy đủ. Có full siles bài giảng!
Nội dung giáo án
CHÀO MỪNG CÁC EM ĐẾN VỚI TIẾT HỌC HÔM NAY
Dựa vào kiến thức đã học của cấp 2, biểu diễn liên kết trong phân tử O2, H2O. Liên kết trong hai chất trên có phải là liên kết ion không? Vì sao?
BÀI 11:
LIÊN KẾT CỘNG HÓA TRỊ
NỘI DUNG BÀI HỌC
- Liên kết cộng hóa trị
- Phân biệt loại liên kết theo độ âm điện
III. Liên kết sigma (σ) và liên kết pi (π)
- Năng lượng của liên kết cộng hóa trị
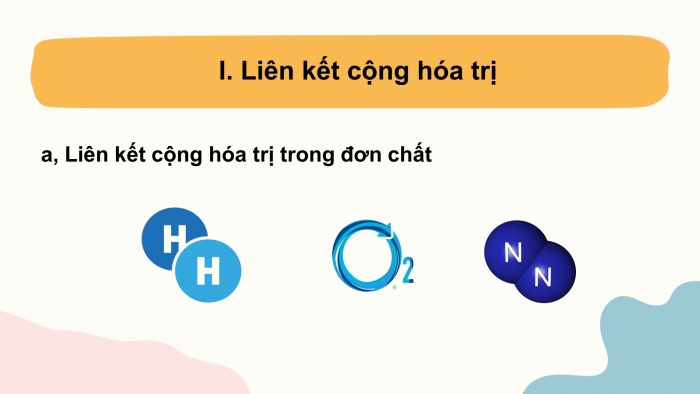
- Liên kết cộng hóa trị
a, Liên kết cộng hóa trị trong đơn chất
Hoạt động nhóm chuyên gia
Nhóm 1
Thực hiện phiếu chuyên sâu 1
Nhóm 2
Thực hiện phiếu chuyên sâu 2
Nhóm 3
Thực hiện phiếu chuyên sâu 3
Phiếu chuyên sâu 1
- Viết cấu hình electron của nguyên tử H (Z = 1)
.………………………………………...............................................................
- Số electron ở lớp ngoài cùng của nguyên tử H. Biểu diễn số electron ở lớp ngoài cùng của H (mỗi một electron là một dấu chấm)
.....................................................................................................................
- Để đạt cấu hình bền vững giống với khí hiếm gần nó nhất là He 1s2 thì H còn thiếu bao nhiêu electron? Trình bày sự hình thành liên kết trong phân tử H2?
......................................................................................................................
Phiếu chuyên sâu 2
- Viết cấu hình electron của nguyên tử O (Z = 8)
......................................................................................................................
- Số electron ở lớp ngoài cùng của nguyên tử O? Biểu diễn số electron ở lớp ngoài cùng của O (mỗi một electron là một dấu chấm)
.....................................................................................................................
- Để đạt cấu hình bền vững giống với khí hiếm gần nó nhất thì O còn thiếu bao nhiêu electron? Trình bày sự hình thành liên kết trong phân tử O2?
......................................................................................................................
Phiếu chuyên sâu 3
- Viết cấu hình electron của nguyên tử N (Z = 7)
........................................................................................................................
- Số electron ở lớp ngoài cùng của nguyên tử N? Biểu diễn số electron ở lớp ngoài cùng của N (mỗi một electron là một dấu chấm)
........................................................................................................................
- Để đạt cấu hình bền vững giống với khí hiếm gần nó thì N còn thiếu bao nhiêu electron? Trình bày sự hình thành liên kết trong phân tử N2?
........................................................................................................................
Đáp án
Phiếu chuyên sâu 1
- 1s1
- H có 1 electron ở lớp vỏ ngoài cùng: H·
- Để đạt cấu hình bền vững giống với khí hiếm gần nó nhất là He 1s2 thì H còn thiếu 1 electron. Sự hình thành liên kết trong H2:
- Nguyên tử H có 1 electron lớp ngoài cùng, để đạt cấu hình khí hiếm gần nhất; mỗi nguyên tử góp chung 1 electron để tạo nên 1 cặp eletron dùng chung cho cả 2 nguyên tử.
- → Liên kết cộng hóa trị: Liên kết đơn
Phiếu chuyên sâu 2
- 1s22s22p4 .
- O có 6 electron ở lớp vỏ ngoài cùng :
- Để đạt cấu hình bền vững giống với khí hiếm gần nó nhất thì O còn thiếu 2 electron. Sự hình thành liên kết trong O2:
- Nguyên tử O có 4 electron lớp ngoài cùng, để đạt cấu hình khí hiếm gần nhất; mỗi nguyên tử góp chung 2 electron để tạo nên 2 cặp eletron dùng chung cho cả 2 nguyên tử.
→ Liên kết cộng hóa trị: Liên kết đôi
Phiếu chuyên sâu 3
- 1s22s22p3
- N có 5 electron ở lớp vỏ ngoài cùng:
- Để đạt cấu hình bền vững giống với khí hiếm gần nó thì N còn 3 electron. Sự hình thành liên kết trong phân tử N2 :
- Nguyên tử N có 5 electron lớp ngoài cùng, để đạt cấu hình khí hiếm gần nhất; mỗi nguyên tử góp chung 3 electron để tạo nên 3 cặp eletron dùng chung cho cả 2 nguyên tử.
→ Liên kết cộng hóa trị: Liên kết 3
Giáo án điện tử hóa học 10 Cánh diều, giáo án powerpoint hóa học 10 Cánh diều bài 11: Liên kết cộng hóa trị, bài giảng điện tử hóa học 10 Cánh diều
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
