Soạn giáo án hóa học 10 cánh diều bài 14: Phản ứng hoá học và enthalpy
Giáo án powerpoint hóa học 10 Cánh diều mới bài bài 14: Phản ứng hoá học và enthalpy. Giáo án soạn theo tiêu chí hiện đại, đẹp mắt với nhiều hình ảnh, nội dung, hoạt động phong phú, sáng tạo. Giáo án điện tử này dùng để giảng dạy online hoặc trình chiếu. Tin rằng, bộ bài giảng này sẽ hỗ trợ tốt việc giảng dạy và đem đến sự hài lòng với thầy cô.









Còn nữa....Giáo án khi tải về là bản đầy đủ. Có full siles bài giảng!
Nội dung giáo án
CHỦ ĐỂ 5: NĂNG LƯỢNG HOÁ HỌC
BÀI 14: PHẢN ỨNG HOÁ HỌC VÀ ENTHALPY
- KHỞI ĐỘNG
Em hãy quan sát các hình ảnh đây và trả lời các câu hỏi sau:
- Viết phương trình phản ứng?
- Phản ứng nào toả nhiệt, phản ứng nào thu nhiệt?
H/A LÒ NUNG VÔI
H/A ĐỐT CHÁY CỒN
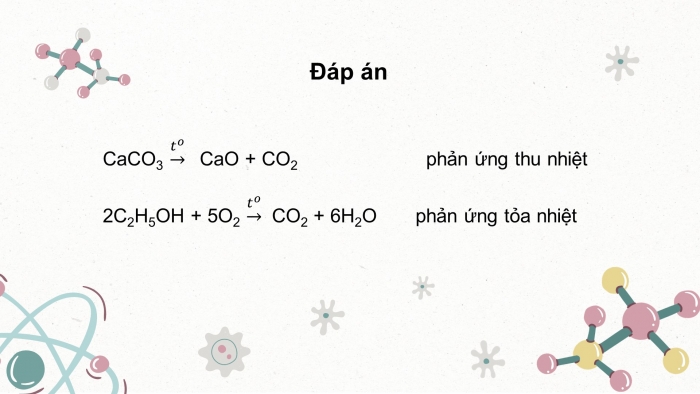
Đáp án
CaO +CO2 phản ứng thu nhiệt
phản ứng tỏa nhiệt
- NỘI DUNG BÀI HỌC
- Phản ứng toả nhiệt và phản ứng thu nhiệt
- Enthalpy tạo thành và biến thiên enthalpy của phản ứng hoá học
III. PHẦN TRIỂN KHAI KIẾN THỨC
- Phản ứng toả nhiệt và phản ứng thu nhiệt
Thảo luận nhóm: tiếnh ành lần lượt 2 thí nghiệm:
+ Thí nghiệm 1: Đặt một nhiệt kế vào trong cốc thủy tinh chứa khoảng 50 mL dung dịch hydrochloric acid (HCl) 1M (hình 14.1). Khi nhiệt độ trong cốc ổn định, ghi nhiệt độ ban đầu. Thêm vào cốc khoảng 1 gam magnesium oxide (MgO) rồi dùng đũa thủy tinh khuấy liên tục. Quan sát hiện tượng phản ứng và ghi lại sự thay đổi nhiệt độ trong quá trình phản ứng.
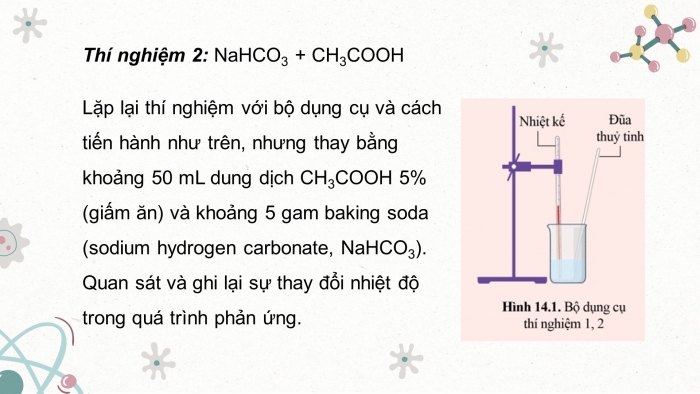
HÌNH 14.1
+ Thí nghiệm 2: Lặp lại thí nghiệm với bộ dụng cụ và cách tiến hành như trên, nhưng thay bằng khoảng 50 mL dung dịch CH3COOH 5% (giấm ăn) và khoảng 5 gam baking soda (sodium hydrogen carbonate, NaHCO3). Quan sát và ghi lại sự thay đổi nhiệt độ trong quá trình phản ứng.
Thực hiện các yêu cầu sau:
(1) Viết phương trình hóa học xảy ra ở hai thí nghiệm trên và cho biết phản ứng nào tỏa nhiệt, phản ứng nào là thu nhiệt?
(2) Khi làm thí nghiệm, làm thế nào để biết một phản ứng là tỏa nhiệt hay thu nhiệt ?
(3) Để thuận lợi cho việc so sánh nhiệt lượng trong các phản ứng , người ta sử dụng điều kiện chuẩn, hãy cho biết điều kiện chuẩn là gì?
Đáp án:
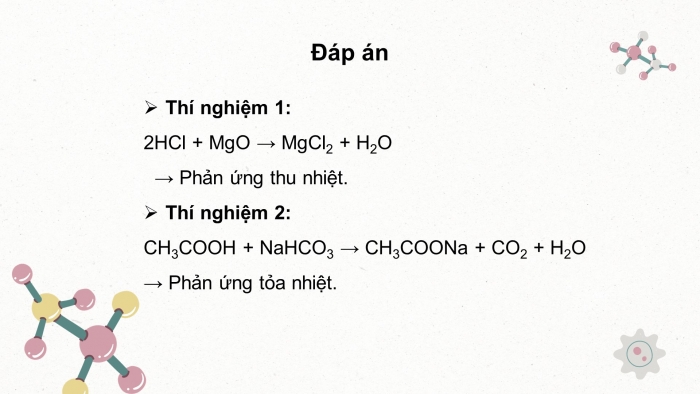
Thí nghiệm 1:
2HCl + MgO → MgCl2 + H2O
Phản ứng thu nhiệt.
Thí nghiệm 2:
CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O
Phản ứng tỏa nhiệt.
Kết luận:
- Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
- Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
- Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (đối với chất khí). nồng độ 1 mol. L-1 (đối với các chất trong dung dịch) và nhiệt độ thường được chọn là 298K (25oC).
Hoạt động nhóm: Hoàn thành Phiếu bài tập số 1
|
PHIẾU BÀI TẬP 1 1) Lấy ví dụ về những phản ứng nào giải phóng năng lượng dưới dạng nhiệt (phản ứng tỏa nhiệt)? Những phản ứng nào hấp thu năng lượng dưới dạng nhiệt? 2) Trong những phản ứng sau phản ứng nào tỏa nhiệt? phản ứng nào thu nhiệt? a) NH4Cl(s) HCl(g) + NH3(g) b) Na2O(s) + H2O(l) → 2NaOH(aq) c) Fe2O3(s) + 2Al(s) Al2O3(s) + 2Fe d) C2H5OH(aq) + O2(g) → CO2(g) + H2O(g) e) Collagen → gelatin |
Đáp án
1)- Phản ứng tỏa nhiệt: phản ứng đốt cháy nhiên liệu, phản ứng tạo gỉ sắt, phản ứng oxi hóa glucose trong cơ thể, ...
- Phản ứng thu nhiệt: phản ứng trong lò nung vôi, nung clinker xi măng,…
2) a) NH4Cl(s) HCl(g) + NH3(g)
Phản ứng thu nhiệt.
- b) Na2O(s) + H2O(l) → 2NaOH(aq)
Phản ứng tỏa nhiệt.
- c) Fe2O3(s) + 2Al(s) Al2O3(s) + 2Fe
Phản ứng tỏa nhiệt.
- d) C2H5OH + O2→ CO2 + H2O
Phản ứng tỏa nhiệt.
- e) Collagen → gelatin
Phản ứng thu nhiệt.
- Enthalpy tạo thành và biến thiên enthalpy của phản ứng hoá học
2.1. Enthalpy tạo thành chuẩn của một chất hoá học
Thực hiện nhiệm vụ: Đọc thông tin mục II.1 SGK và trả lời câu hỏi:
+ Thế nào là enthalpy tạo thành chuẩn của một chất hoá học?
+ Kí hiệu enthalpy tạo thành chuẩn của một chất hoá học?
Đáp án
Enthalpy tạo thành chuẩn (nhiệt tạo thành chuẩn) của một chất là lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn.
- Kí hiệu:
Trong đó: f viết tắt của formation (sự tạo thành)
H: enthalpy
0: số chỉ điều kiện chuẩn
298: 298K hay 250C.
Nếu > 0 : phản ứng thu nhiệt.
Nếu < 0 : phản ứng tỏa nhiệt.
Em hãy đọc VD1 và VD2
= −417,98 kJ.mol-
= - 26,48 kJ.mol-
Em hãy hoàn thành Phiếu học tập số 2:
Giáo án điện tử hóa học 10 Cánh diều, giáo án powerpoint hóa học 10 Cánh diều bài 14: Phản ứng hoá học và enthalpy, bài giảng điện tử hóa học 10 Cánh diều
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
