Đáp án Hóa học 12 Cánh diều bài 11: Nguồn điện hóa học
Đáp án bài 11: Nguồn điện hóa học. Bài giải được trình bày ngắn gọn, chính xác giúp các em học Hóa học 12 Cánh diều dễ dàng. Từ đó, hiểu bài và vận dụng vào các bài tập khác. Đáp án chuẩn chỉnh, rõ ý, dễ tiếp thu. Kéo xuống dưới để xem chi tiết
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 11: NGUỒN ĐIỆN HÓA HỌC
MỞ ĐẦU
Hình 11.1 mô tả một số loại pin thường được sử dụng trong đời sống. Vậy hoạt động của các pin trên dựa trên loại phản ứng hóa học nào?
Đáp án chuẩn:
Oxi hóa – khử.
I. CẤU TẠO VÀ NGUYÊN TẮC HOẠT ĐỘNG CỦA PIN GALVANI
Câu hỏi 1: Khi nhúng một thanh kẽm vào dung dịch CuSO4 thì electron từ thanh kẽm sẽ chuyển trực tiếp hay gián tiếp đến ion Cu2+ trong dung dịch? Giải thích.
Đáp án chuẩn:
Trực tiếp vì thanh kẽm tiếp xúc trực tiếp với CuSO4.
Luyện tập 1: Hãy mô tả cấu tạo mỗi pin Galvani sau:
- Fe-Cu.
- Cu-Ag.
- Fe-Ag.
Đáp án chuẩn:
a) Cắm Fe vào cốc Fe2+ và Cu vào cốc Cu2+ được nối sẵn cầu muối, hai thanh kim loại được nối với một vôn kế bằng dây dẫn điện.
b) Cắm Cu vào cốc Cu2+ và Ag vào cốc Ag+được nối sẵn cầu muối, hai thanh kim loại được nối với một vôn kế bằng dây dẫn điện.
c) Cắm Fe vào cốc Fe2+ và Ag vào cốc Ag+ được nối sẵn cầu muối, hai thanh kim loại được nối với một vôn kế bằng dây dẫn điện.
Luyện tập 2: Hãy nêu nguyên tắc hoạt động của pin Galvani Zn-Ag và viết phương trình hóa học của phản ứng xảy ra trong pin.
Đáp án chuẩn:
Tại anode: Zn nhường electron, chuyển thành Zn2+ tan vào dung dịch.
Tại cathode: Ag+ nhận electron chuyển thành Ag bám lên điện cực Ag.
![]()
Câu hỏi 2: Cho biết thế điện cực chuẩn của cặp ![]() và
và ![]() . Hãy tìm biểu thức liên hệ hai giá trị này với giá trị sức điện động chuẩn của pin Zn-Cu (bằng 1,103 V).
. Hãy tìm biểu thức liên hệ hai giá trị này với giá trị sức điện động chuẩn của pin Zn-Cu (bằng 1,103 V).
Đáp án chuẩn:
![]()
II. THỰC HÀNH LẮP MỘT SỐ PIN ĐƠN GIẢN
Luyện tập 3: Từ Bảng 10.1, hãy so sánh sức điện động chuẩn của pin Galvani Zn-Ni và Sn-Cu.
Đáp án chuẩn:
![]() >
> ![]()
Thí nghiệm: Thực hành lắp pin đơn giản.
Chuẩn bị:
- Hóa chất: Hai thanh (hoặc dây) kim loại khác nhau (ví dụ đồng, kẽm,...), dung dịch chất điện li (ví dụ dung dịch HCl, H2SO4 loãng, NaCl,... hoặc quả chanh, quả táo,...).
- Dụng cụ: Vôn kế (hoặc đèn led nhỏ để nhận biết sự xuất hiện của dòng điện), dây dẫn, cốc thủy tinh.
Tiến hành:
- Cắm hai thanh (hoặc dây) kim loại vào cốc chứa dung dịch chất điện li (hoặc quả chanh, quả táo,...).
- Đo sức điện động giữa hai thanh (hoặc dây) kim loại bằng vôn kế (Hình 11.3).
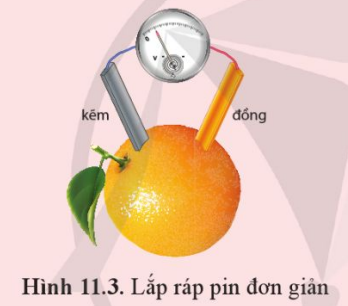
Yêu cầu: Quan sát và mô tả hiện tượng xảy ra.
Chú ý an toàn: Hai thanh kim loại trong pin không được chạm vào nhau.
Đáp án chuẩn:
Vôn kế có sự dịch chuyển.
III. GIỚI THIỆU MỘT SỐ LOẠI PIN THÔNG DỤNG KHÁC
Vận dụng 1: Tìm hiểu và cho biết một số hạn chế nếu sử dụng pin Galvani Zn-Cu trong đèn pin.
Đáp án chuẩn:
Ô nhiễm môi trường, ngộ độc kim loại, tuổi thọ thấp
Luyện tập 4: Hãy nêu một số trường hợp sử dụng acquy trong thực tế mà em biết.
Đáp án chuẩn:
Xe điện, xe máy, ô tô...
Câu hỏi 3: Mỗi phát biểu sau đây là đúng hay sai?
- Pin mặt trời biến đổi trực tiếp quang năng thành điện năng.
- Pin mặt trời là nguồn năng lượng xanh.
- Khi hoạt động, pin mặt trời không gây hiệu ứng nhà kính.
- Khi hoạt động, pin mặt trời gây mưa acid và làm Trái Đất nóng lên.
Đáp án chuẩn:
a) b) c) Đúng.
d) Sai
Vận dụng 2: Tìm hiểu và giải thích những vùng miền nào ở Việt Nam thích hợp với việc phát triển điện mặt trời.
Đáp án chuẩn:
Miền Trung và miền Nam rất do điều kiện thuận lợi với lượng bức xạ mặt trời và tổng số giờ nắng trong năm cao.
BÀI TẬP
Bài 1: Sử dụng bảng thế điện cực chuẩn, xác định sức điện động chuẩn của pin Galvani tạo bởi các cặp oxi hóa – khử sau, đồng thời chỉ ra điện cực dương, điện cực âm của pin trong mỗi trường hợp:
|
|
Đáp án chuẩn:
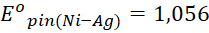 (V)
(V)
Điện cực +: Ni; Điện cực -: Ag.
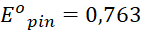 (V)
(V)
Điện cực +: Zn; Điện cực - : H+.
Bài 2: Nêu ý kiến của em về nhận định: Pin nhiên liệu hydrogen và pin mặt trời sẽ ngày càng được sử dụng rộng rãi trong tương lai.
Đáp án chuẩn:
Nhận định trên là đúng
Bài 3: Phát biểu nào sau đây là đúng khi nói về pin Galvani?
- Anode là điện cực dương.
- Cathode là điện cực âm.
- Ở điện cực âm xảy ra quá trình oxi hóa.
- Dòng electron di chuyển từ cathode sang anode.
Đáp án chuẩn:
D
Bài 4: Những phát biểu nào sau đây là đúng?
- Phản ứng hóa học xảy ra trong pin Galvani là phản ứng tự diễn biến.
- Trong pin Galvani, điện cực âm là nơi xảy ra quá trình khử.
- Sức điện động của pin Galvani là hiệu điện thế giữa hai điện cực.
- Pin Galvani tạo ra dòng điện từ quá trình vật lí.
Đáp án chuẩn:
(a), (b) đúng
c) d) Sai
Bài 5: Cho phản ứng trong một pin Galvani như sau:
![]()
Hãy cho biết quá trình xảy ra ở anode và cathode khi pin hoạt động.
Đáp án chuẩn:
Anode: ![]()
Cathode: ![]()
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
Giải bài tập những môn khác
Môn học lớp 12 KNTT
5 phút giải toán 12 KNTT
5 phút soạn bài văn 12 KNTT
Văn mẫu 12 KNTT
5 phút giải vật lí 12 KNTT
5 phút giải hoá học 12 KNTT
5 phút giải sinh học 12 KNTT
5 phút giải KTPL 12 KNTT
5 phút giải lịch sử 12 KNTT
5 phút giải địa lí 12 KNTT
5 phút giải CN lâm nghiệp 12 KNTT
5 phút giải CN điện - điện tử 12 KNTT
5 phút giải THUD12 KNTT
5 phút giải KHMT12 KNTT
5 phút giải HĐTN 12 KNTT
5 phút giải ANQP 12 KNTT
Môn học lớp 12 CTST
5 phút giải toán 12 CTST
5 phút soạn bài văn 12 CTST
Văn mẫu 12 CTST
5 phút giải vật lí 12 CTST
5 phút giải hoá học 12 CTST
5 phút giải sinh học 12 CTST
5 phút giải KTPL 12 CTST
5 phút giải lịch sử 12 CTST
5 phút giải địa lí 12 CTST
5 phút giải THUD 12 CTST
5 phút giải KHMT 12 CTST
5 phút giải HĐTN 12 bản 1 CTST
5 phút giải HĐTN 12 bản 2 CTST
Môn học lớp 12 cánh diều
5 phút giải toán 12 CD
5 phút soạn bài văn 12 CD
Văn mẫu 12 CD
5 phút giải vật lí 12 CD
5 phút giải hoá học 12 CD
5 phút giải sinh học 12 CD
5 phút giải KTPL 12 CD
5 phút giải lịch sử 12 CD
5 phút giải địa lí 12 CD
5 phút giải CN lâm nghiệp 12 CD
5 phút giải CN điện - điện tử 12 CD
5 phút giải THUD 12 CD
5 phút giải KHMT 12 CD
5 phút giải HĐTN 12 CD
5 phút giải ANQP 12 CD
Giải chuyên đề học tập lớp 12 kết nối tri thức
Giải chuyên đề Ngữ văn 12 Kết nối tri thức
Giải chuyên đề Toán 12 Kết nối tri thức
Giải chuyên đề Vật lí 12 Kết nối tri thức
Giải chuyên đề Hóa học 12 Kết nối tri thức
Giải chuyên đề Sinh học 12 Kết nối tri thức
Giải chuyên đề Kinh tế pháp luật 12 Kết nối tri thức
Giải chuyên đề Lịch sử 12 Kết nối tri thức
Giải chuyên đề Địa lí 12 Kết nối tri thức
Giải chuyên đề Tin học ứng dụng 12 Kết nối tri thức
Giải chuyên đề Khoa học máy tính 12 Kết nối tri thức
Giải chuyên đề Công nghệ 12 Điện - điện tử Kết nối tri thức
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Kết nối tri thức
Giải chuyên đề học tập lớp 12 chân trời sáng tạo
Giải chuyên đề Ngữ văn 12 Chân trời sáng tạo
Giải chuyên đề Toán 12 Chân trời sáng tạo
Giải chuyên đề Vật lí 12 Chân trời sáng tạo
Giải chuyên đề Hóa học 12 Chân trời sáng tạo
Giải chuyên đề Sinh học 12 Chân trời sáng tạo
Giải chuyên đề Kinh tế pháp luật 12 Chân trời sáng tạo
Giải chuyên đề Lịch sử 12 Chân trời sáng tạo
Giải chuyên đề Địa lí 12 Chân trời sáng tạo
Giải chuyên đề Tin học ứng dụng 12 Chân trời sáng tạo
Giải chuyên đề Khoa học máy tính 12 Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Điện - điện tử Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Chân trời sáng tạo
Giải chuyên đề học tập lớp 12 cánh diều
Giải chuyên đề Ngữ văn 12 Cánh diều
Giải chuyên đề Toán 12 Cánh diều
Giải chuyên đề Vật lí 12 Cánh diều
Giải chuyên đề Hóa học 12 Cánh diều
Giải chuyên đề Sinh học 12 Cánh diều
Giải chuyên đề Kinh tế pháp luật 12 Cánh diều
Giải chuyên đề Lịch sử 12 Cánh diều
Giải chuyên đề Địa lí 12 Cánh diều
Giải chuyên đề Tin học ứng dụng 12 Cánh diều
Giải chuyên đề Khoa học máy tính 12 Cánh diều
Giải chuyên đề Công nghệ 12 Điện - điện tử Cánh diều
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Cánh diều

Bình luận