Đáp án Hóa học 12 Cánh diều bài 18: Nguyên tố nhóm IIA
Đáp án bài 18: Nguyên tố nhóm IIA. Bài giải được trình bày ngắn gọn, chính xác giúp các em học Hóa học 12 Cánh diều dễ dàng. Từ đó, hiểu bài và vận dụng vào các bài tập khác. Đáp án chuẩn chỉnh, rõ ý, dễ tiếp thu. Kéo xuống dưới để xem chi tiết
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 18: NGUYÊN TỐ NHÓM IIA
MỞ ĐẦU
Nguyên tố nhóm IIA và một số hợp chất của chúng có nhiều ứng dụng trong thực tiễn (Hình 18.1).
- Nêu một số ứng dụng của đơn chất và hợp chất của nguyên tố nhóm IIA mà em biết.
- Kim loại nhóm IIA có những tính chất vật lí và tính chất hóa học nào?
Đáp án chuẩn:
a) Chế tạo máy bay, ô tô, điều chế dược liệu, sản xuất thủy tinh...
b) Tính chất vật lí: kim loại nhẹ, độ nóng chảy cao, khối lượng riêng tăng không theo xu hướng rõ rệt.
Tính chất hóa học: phản ứng với oxygen và với nước.
I. TRẠNG THÁI TỰ NHIÊN
II. ĐƠN CHẤT
Câu hỏi 1: Trong cùng chu kì, kim loại nhóm IIA có tính khử mạnh hơn hay yếu hơn so với tính khử của kim loại nhóm IA? Giải thích.
Đáp án chuẩn:
Tính khử mạnh hơn. Vì lớp e ngoài cùng của kim loại kiềm ít hơn của kim loại kiềm thổ 1 electron.
Câu hỏi 2: Dựa vào tính khử của kim loại và độ tan của các hydroxide, dự đoán:
- Magnesium hay barium phản ứng với oxygen mạnh hơn.
- Calcium hay barium phản ứng với nước mạnh hơn.
Đáp án chuẩn:
- Barium
- Calcium
Câu hỏi 3: Vì sao magnesium phản ứng rất chậm với nước?
Đáp án chuẩn:
Do màng oxide MgO bọc bên ngoài bảo vệ.
Vận dụng 1: Tìm hiểu và cho biết, ngoài tham gia tạo hợp kim, các kim loại nhóm IIA còn có những ứng dụng nào khác.
Đáp án chuẩn:
Chất phụ gia (Be), thuốc dinh dưỡng (Ca), chế tạo phân bón (Mg), chất tạo màu (Ba).
Luyện tập 1: Magnesium là kim loại cơ bản trong hợp kim dùng để chế tạo khung và cánh của các thiết bị bay (Hình 18.3). Theo em, ứng dụng trên dựa vào tính chất nào của hợp kim magnesium?
Đáp án chuẩn:
Cường độ chịu lực riêng, dễ đúc dễ tạo hình và không bị nhiễm từ.
III. HỢP CHẤT CỦA CÁC NGUYÊN TỐ NHÓM IIA
Thí nghiệm 1: So sánh độ tan của muối BaSO4 và CaSO4.
Chuẩn bị:
- Hóa chất: Dung dịch BaCl2, CaCl2 cùng nồng độ 0,1 M; dung dịch CuSO4 5%.
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt.
Tiến hành: Cho 2 mL dung dịch BaCl2 vào ống nghiệm (1), 2 mL dung dịch CaCl2 vào ống nghiệm (2). Cho từ từ từng giọt dung dịch CuSO4 vào mỗi ống nghiệm và lắc đều cho đến khi có kết tủa trong ống nghiệm thì dừng lại.
Yêu cầu: Quan sát hiện tượng, so sánh thời điểm xuất hiện kết tủa trong mỗi ống nghiệm, giải thích.
Đáp án chuẩn:
Kết tủa (2) sớm (1), do độ tan của ion Ca2+ cao hơn của ion Ba2+.
Câu hỏi 4: Phản ứng giữa các chất nào sau đây tạo ra chất không tan?
Đáp án chuẩn:
(a), (d).
Luyện tập 2: Vì sao các khoáng vật calcite, dolomite,... hầu như không tan trong nước?
Đáp án chuẩn:
Do thành phần là muối của kim loại kiềm thổ
Câu hỏi 5: Dùng nước có thể phân biệt MgCO3(s) và Mg(NO3)2(s) được không? Giải thích.
Đáp án chuẩn:
Có, bởi vì: MgCO3 không tan trong nước, Mg(NO3)2 có tan.
Luyện tập 3: Một mẫu nước giếng có chứa các ion Ca2+, Na+, Mg2+, Cl- và SO42-. Viết phương trình hóa học của các phản ứng tạo chất không tan khi cho dung dịch soda vào mẫu nước giếng trên.
Đáp án chuẩn:
![]()
![]()
Luyện tập 4: Vì sao khi có sự gia tăng nồng độ của carbon dioxide trong nước biển thì các rạn san hô và núi đá vôi có thể bị phá hủy, xói mòn?
Đáp án chuẩn:
Vì tính acid trong nước biển tăng.
Câu hỏi 6: Dựa vào Bảng 18.4, hãy cho biết quá trình phân hủy 1 mol muối carbonate của nguyên tố nhóm IIA nào cần hấp thu nhiều năng lượng hơn.
Đáp án chuẩn:
BaCO3
Thí nghiệm 2: Thí nghiệm kiểm tra sự có mặt của các ion Ca2+, Ba2+, SO42-, CO32-.
Thí nghiệm kiểm tra sự có mặt của ion Ca2+ trong dung dịch.
Chuẩn bị:
- Hóa chất: Dung dịch CaCl2 0,1 M; Na2CO3 0,1 M; HCl 1,0 M.
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt.
Tiến hành: Cho vào ống nghiệm khoảng 2 mL dung dịch CaCl2, thêm từ từ cho đến hết khoảng 10 giọt dung dịch Na2CO3, lắc đều. Tiếp tục thêm vào khoảng 10 giọt dung dịch HCl, lắc đều.
Yêu cầu: Quan sát, mô tả hiện tượng và viết phương trình hóa học của phản ứng xảy ra.
Đáp án chuẩn:
Ban đầu: tủa trắng, cho HCl: khí bay lên và tủa hòa tan.
![]()
![]()
Thí nghiệm kiểm tra sự có mặt của ion Ba2+ trong dung dịch.
Chuẩn bị:
- Hóa chất: Dung dịch BaCl2 0,1 M; H2SO4 1,0 M.
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt.
Tiến hành: Cho vào ống nghiệm khoảng 2 mL dung dịch BaCl2, thêm từ từ cho đến hết khoảng 6 – 8 giọt dung dịch H2SO4, lắc đều.
Yêu cầu: Quan sát, mô tả hiện tượng và viết phương trình hóa học của phản ứng xảy ra.
Đáp án chuẩn:
Tủa trắng.
![]()
Thí nghiệm kiểm tra sự có mặt của ion SO42- trong dung dịch.
Chuẩn bị:
- Hóa chất: Dung dịch ZnSO4 0,1 M; BaCl2 0,1 M; HCl 1,0 M.
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt.
Tiến hành: Cho vào ống nghiệm khoảng 2 mL dung dịch ZnSO4, thêm từ từ cho đến hết khoảng 10 giọt dung dịch BaCl2, lắc đều. Tiếp tục thêm vào khoảng 2 – 3 giọt dung dịch HCl, lắc đều.
Yêu cầu: Quan sát, mô tả hiện tượng và viết phương trình hóa học của phản ứng xảy ra.
Đáp án chuẩn:
Có tủa trắng, cho HCl kết tủa không bị hòa tan.
![]()
Thí nghiệm kiểm tra sự có mặt của ion CO32- trong dung dịch.
Chuẩn bị:
- Hóa chất: Dung dịch Na2CO3 1,0 M; HCl 1,0 M.
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt, giấy chỉ thị pH.
Tiến hành: Cho vào ống nghiệm khoảng 1 mL dung dịch Na2CO3. Dùng giấy chỉ thị pH để kiểm tra môi trường dung dịch. Thêm tiếp 2 mL dung dịch HCl vào ống nghiệm, lắc đều, đưa que diêm đang cháy đến miệng ống nghiệm.
Yêu cầu: Quan sát, mô tả hiện tượng và viết phương trình hóa học của phản ứng xảy ra.
Đáp án chuẩn:
Giấy chỉ thị: màu xanh nhạt. Sau đó: xuất hiện khí bay lên.
![]()
IV. NHẬN BIẾT KIM LOẠI VÀ ION KIM LOẠI NHÓM IIA
Vận dụng 2: Tìm hiểu các triệu chứng của các bệnh về răng và xương có liên quan đến sự thiếu hụt calcium trong cơ thể. Đề xuất một số biện pháp để phòng tránh, hạn chế bệnh trên.
Đáp án chuẩn:
Triệu chứng: móng tay yếu, đau mỏi khớp, vàng răng, sâu răng,...
Biện pháp: uống và ăn giàu calcium như sữa và các loại hạt, tránh ăn đồ ngọt, sử dụng thuốc bổ sung calcium,...
BÀI TẬP
Bài 1: Nêu các đặc điểm giống nhau và khác nhau về cấu tạo nguyên tử và tính chất giữa kim loại nhóm IIA với kim loại kiềm.
Đáp án chuẩn:
Điểm giống: tính khử mạnh, tan trong nước, cháy trong oxygen.
Điểm khác:
- IA: tính khử mạnh hơn, các muối đều tan, cấu hình [KH]ns1.
- IIA: tính khử yếu hơn, có nhiều muối không tan, cấu hình [KH]ns2.
Bài 2: Dựa vào giá trị thế điện cực chuẩn của kim loại (Bảng 10.1) và giá trị thế điện cực chuẩn của quá trình ![]() là
là ![]() ở pH = 7, hãy:
ở pH = 7, hãy:
- Sắp xếp Na, Mg, Cu theo dãy tăng dần tính khử của kim loại.
- Giải thích vì sao Na và Mg tác dụng được với nước.
Đáp án chuẩn:
- Cu, Mg, Na.
- Do
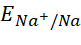 và
và 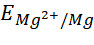 đều nhỏ hơn
đều nhỏ hơn 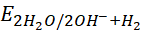
Bài 3: Khi cho lượng soda phù hợp vào dung dịch có chứa cation Ca2+ và Mg2+ thì hai cation này sẽ bị tách ra khỏi dung dịch. Viết phương trình hóa học minh họa.
Đáp án chuẩn:
![]()
![]()
Bài 4: Đề xuất phương án phân biệt các dung dịch không màu CaCl2, BaCl2, KCl, NaCl và Na2CO3.
Đáp án chuẩn:
Dùng HCl để phân biệt Na2CO3 (nhờ có khí bay lên).
Đốt các dung dịch còn lại trên ngọn lửa (NaCl cho ngọn lửa màu vàng, KCL cho ngọn lửa màu tím, CaCl2 cho ngọn lửa màu đỏ cam, BaCl2 cho ngọn lửa màu lục).
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
Giải bài tập những môn khác
Môn học lớp 12 KNTT
5 phút giải toán 12 KNTT
5 phút soạn bài văn 12 KNTT
Văn mẫu 12 KNTT
5 phút giải vật lí 12 KNTT
5 phút giải hoá học 12 KNTT
5 phút giải sinh học 12 KNTT
5 phút giải KTPL 12 KNTT
5 phút giải lịch sử 12 KNTT
5 phút giải địa lí 12 KNTT
5 phút giải CN lâm nghiệp 12 KNTT
5 phút giải CN điện - điện tử 12 KNTT
5 phút giải THUD12 KNTT
5 phút giải KHMT12 KNTT
5 phút giải HĐTN 12 KNTT
5 phút giải ANQP 12 KNTT
Môn học lớp 12 CTST
5 phút giải toán 12 CTST
5 phút soạn bài văn 12 CTST
Văn mẫu 12 CTST
5 phút giải vật lí 12 CTST
5 phút giải hoá học 12 CTST
5 phút giải sinh học 12 CTST
5 phút giải KTPL 12 CTST
5 phút giải lịch sử 12 CTST
5 phút giải địa lí 12 CTST
5 phút giải THUD 12 CTST
5 phút giải KHMT 12 CTST
5 phút giải HĐTN 12 bản 1 CTST
5 phút giải HĐTN 12 bản 2 CTST
Môn học lớp 12 cánh diều
5 phút giải toán 12 CD
5 phút soạn bài văn 12 CD
Văn mẫu 12 CD
5 phút giải vật lí 12 CD
5 phút giải hoá học 12 CD
5 phút giải sinh học 12 CD
5 phút giải KTPL 12 CD
5 phút giải lịch sử 12 CD
5 phút giải địa lí 12 CD
5 phút giải CN lâm nghiệp 12 CD
5 phút giải CN điện - điện tử 12 CD
5 phút giải THUD 12 CD
5 phút giải KHMT 12 CD
5 phút giải HĐTN 12 CD
5 phút giải ANQP 12 CD
Giải chuyên đề học tập lớp 12 kết nối tri thức
Giải chuyên đề Ngữ văn 12 Kết nối tri thức
Giải chuyên đề Toán 12 Kết nối tri thức
Giải chuyên đề Vật lí 12 Kết nối tri thức
Giải chuyên đề Hóa học 12 Kết nối tri thức
Giải chuyên đề Sinh học 12 Kết nối tri thức
Giải chuyên đề Kinh tế pháp luật 12 Kết nối tri thức
Giải chuyên đề Lịch sử 12 Kết nối tri thức
Giải chuyên đề Địa lí 12 Kết nối tri thức
Giải chuyên đề Tin học ứng dụng 12 Kết nối tri thức
Giải chuyên đề Khoa học máy tính 12 Kết nối tri thức
Giải chuyên đề Công nghệ 12 Điện - điện tử Kết nối tri thức
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Kết nối tri thức
Giải chuyên đề học tập lớp 12 chân trời sáng tạo
Giải chuyên đề Ngữ văn 12 Chân trời sáng tạo
Giải chuyên đề Toán 12 Chân trời sáng tạo
Giải chuyên đề Vật lí 12 Chân trời sáng tạo
Giải chuyên đề Hóa học 12 Chân trời sáng tạo
Giải chuyên đề Sinh học 12 Chân trời sáng tạo
Giải chuyên đề Kinh tế pháp luật 12 Chân trời sáng tạo
Giải chuyên đề Lịch sử 12 Chân trời sáng tạo
Giải chuyên đề Địa lí 12 Chân trời sáng tạo
Giải chuyên đề Tin học ứng dụng 12 Chân trời sáng tạo
Giải chuyên đề Khoa học máy tính 12 Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Điện - điện tử Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Chân trời sáng tạo
Giải chuyên đề học tập lớp 12 cánh diều
Giải chuyên đề Ngữ văn 12 Cánh diều
Giải chuyên đề Toán 12 Cánh diều
Giải chuyên đề Vật lí 12 Cánh diều
Giải chuyên đề Hóa học 12 Cánh diều
Giải chuyên đề Sinh học 12 Cánh diều
Giải chuyên đề Kinh tế pháp luật 12 Cánh diều
Giải chuyên đề Lịch sử 12 Cánh diều
Giải chuyên đề Địa lí 12 Cánh diều
Giải chuyên đề Tin học ứng dụng 12 Cánh diều
Giải chuyên đề Khoa học máy tính 12 Cánh diều
Giải chuyên đề Công nghệ 12 Điện - điện tử Cánh diều
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Cánh diều

Bình luận