Soạn giáo án điện tử KHTN 7 Cánh diều bài 5: Giới thiệu về liên kết hoá học
Giáo án powerpoint Khoa học tự nhiên 7 cánh diều mới bài bài 5: Giới thiệu về liên kết hoá học. Giáo án soạn theo tiêu chí hiện đại, đẹp mắt với nhiều hình ảnh, nội dung, hoạt động phong phú, sáng tạo. Giáo án điện tử này dùng để giảng dạy online hoặc trình chiếu. Tin rằng, bộ bài giảng này sẽ hỗ trợ tốt việc giảng dạy và đem đến sự hài lòng với thầy cô.










Còn nữa....Giáo án khi tải về là bản đầy đủ. Có full siles bài giảng!
Nội dung giáo án
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC NGÀY HÔM NAY
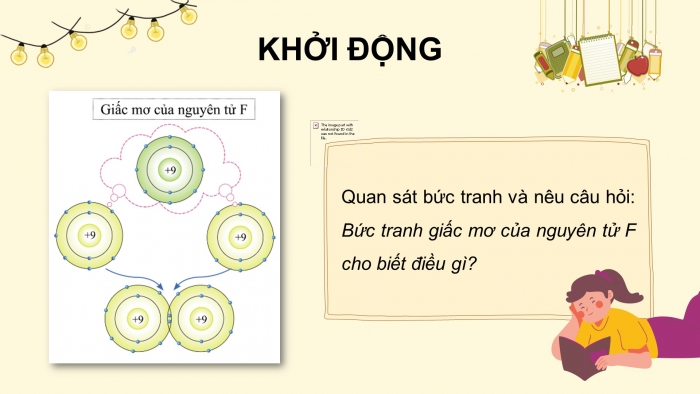
KHỞI ĐỘNG
Quan sát bức tranh và nêu câu hỏi: Bức tranh giấc mơ của nguyên tử F cho biết điều gì?
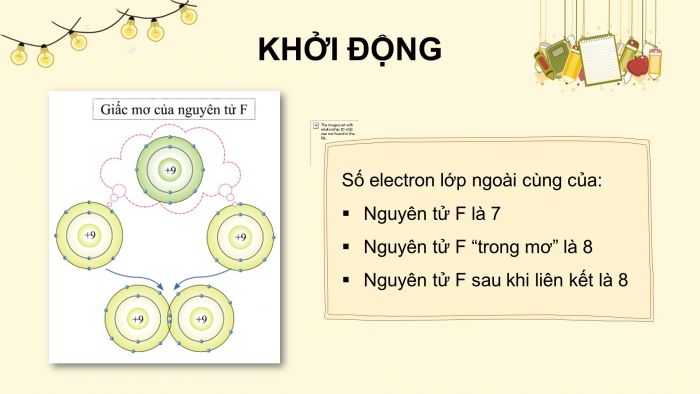
Số electron lớp ngoài cùng của:
- Nguyên tử F là 7
- Nguyên tử F “trong mơ” là 8
- Nguyên tử F sau khi liên kết là 8
BÀI 5: GIỚI THIỆU VỀ LIÊN KẾT HOÁ HỌC
NỘI DUNG BÀI HỌC
Đặc điểm cấu tạo vỏ nguyên tử khí hiếm
Liên kết ion
Liên kết cộng hoá trị
- Đặc điểm cấu tạo vỏ nguyên tử khí hiếm
- Quan sát hình 5.1, hãy cho biết số electron ở lớp ngoài cùng của vỏ nguyên tử khí hiếm
- Lớp vỏ ngoài cùng của các nguyên tử khí hiếm có 8 electron (riêng He có 2 electron).
- Tại sao chỉ có các nguyên tử khí hiếm tồn tại độc lập còn các nguyên tử của các nguyên tố khác lại liên kết với nhau?
- Lớp ngoài cùng của các nguyên tử khí hiếm có 8 electron (riêng He có 2 electron) là lớp vỏ bền vững.
- Các nguyên tử khí hiếm tồn tại độc lập trong điều kiện thường.
- Nguyên tử của các nguyên tố khác có lớp ngoài cùng kém bền, có xu hướng tạo ra lớp vỏ tương tự khí hiếm khi liên kết với nguyên tử khác.
- Liên kết ion
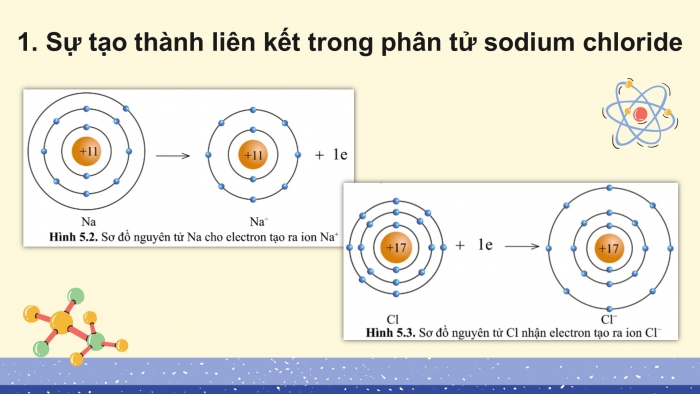
- Sự tạo thành liên kết trong phân tử sodium chloride
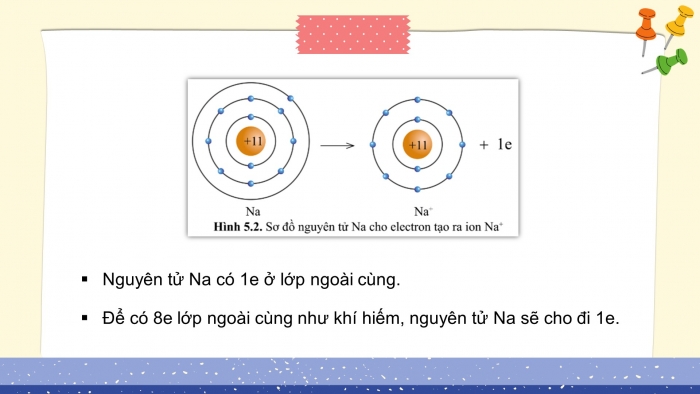
- Nguyên tử Na có 1e ở lớp ngoài cùng.
- Để có 8e lớp ngoài cùng như khí hiếm, nguyên tử Na sẽ cho đi 1e.
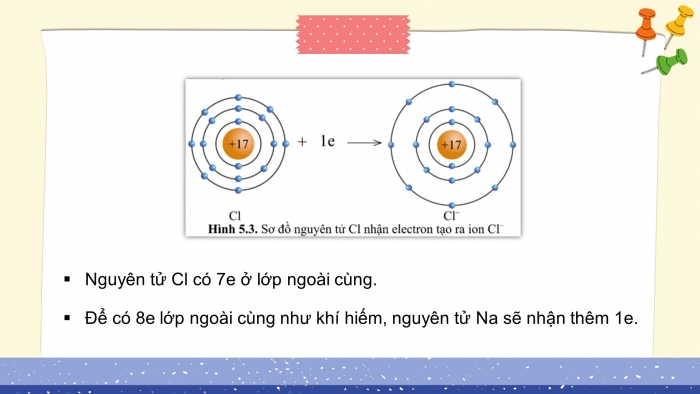
- Nguyên tử Cl có 7e ở lớp ngoài cùng.
- Để có 8e lớp ngoài cùng như khí hiếm, nguyên tử Na sẽ nhận thêm 1e.
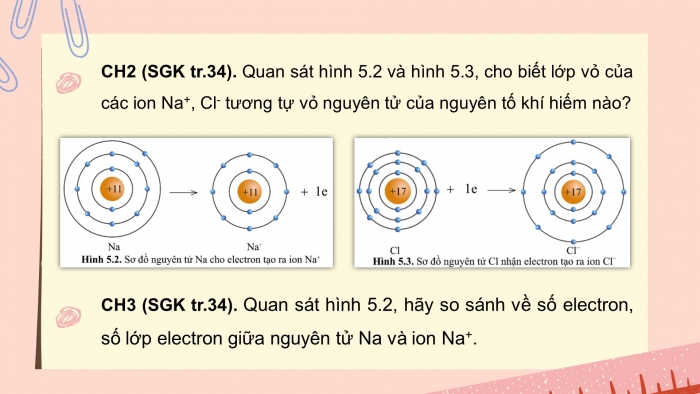
- CH2 (SGK tr.34). Quan sát hình 5.2 và hình 5.3, cho biết lớp vỏ của các ion Na+, Cl- tương tự vỏ nguyên tử của nguyên tố khí hiếm nào?
- CH3 (SGK tr.34). Quan sát hình 5.2, hãy so sánh về số electron, số lớp electron giữa nguyên tử Na và ion Na+.
Ion Na+:
- Có 10 electron ở lớp vỏ.
- Có 2 lớp electron.
- Lớp vỏ ion Na+ tương tự vỏ nguyên tử của nguyên tố khí hiếm Ne.
Ion Cl-:
- Có 18 electron ở lớp vỏ.
- Có 3 lớp electron.
Lớp vỏ ion Cl- tương tự vỏ nguyên tử của nguyên tố khí hiếm Aron.
Nguyên tử Na có 11 electron, 3 lớp electron.
Ion Na+ có 10 electron, 2 lớp electron.
Nguyên tử Na đã cho đi 1e lớp ngoài cùng để trở thành ion mang điện tích dương, kí hiệu là Na+
Các ion Na+ và Cl- hút nhau để tạo thành liên kết trong phân tử sodium chloride
Luyện tập 1 (SGK tr.35). Số electron ở lớp ngoài cùng của nguyên tử K và F lần lượt là 1 và 7. Hãy cho biết khi K kết hợp với F để tạo thành phân tử potassium fluoride, nguyên tử K cho hay nhận bao nhiêu electron. Vẽ sơ đồ tạo thành liên kết trong phân tử potassium fluoride.
Lời giải. Khi K kết hợp với F để tạo thành phân tử potassium fluoride sẽ diễn ra sự cho và nhận electron giữa hai nguyên tử như sau:
Nguyên tử K cho đi 1e ở lớp ngoài cùng trở thành ion mang điện tích dương, kí hiệu K+ .
Nguyên tử F nhận 1e từ nguyên tử K trở thành ion mang một điện tích âm, kí hiệu là F- .
Các ion K+ và F- hút nhau tạo thành liên kết trong phân tử potassium fluoride.
Giáo án điện tử Khoa học tự nhiên 7 cánh diều, giáo án powerpoint Khoa học tự nhiên 7 cánh diều bài 5: Giới thiệu về liên kết hoá, bài giảng điện tử Khoa học tự nhiên 7 cánh diều
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
