Lý thuyết trọng tâm hóa học 10 kết nối bài 10: Quy tắc Octet
Tổng hợp kiến thức trọng tâm hóa học 10 kết nối tri thức bài 10: Quy tắc Octet. Tài liệu nhằm củng cố, ôn tập lại nội dung kiến thức bài học cho học sinh dễ nhớ, dễ ôn luyện. Kéo xuống để tham khảo
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
I. KHÁI NIỆM LIÊN KẾT HÓA HỌC
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
Electron hóa trị là các electron có khả năng tham gia tạo thành liên kết hóa học, chúng thường nằm ở lớp electron ngoài cùng và phân lớp sát ngoài cùng.
Các electron hóa trị của nguyên tử một nguyên tố được quy ước biểu diễn bằng các dấu chấm đặt xung quanh kí hiệu nguyên tố. Mỗi dấu chấm đại diện cho một electron.
Ví dụ: Oxygen có 6 electron hóa trị:
Cách biểu diễn: ![]()
Carbon có 4 electron hóa trị:
Cách biểu diễn: : C :
Bảng biểu diễn electron hóa trị của một số nguyên tử:
Nhóm | Nguyên tử | Biểu diễn nguyên tử với electron hóa trị |
IA | K |
|
IIA | Ca | Ca: |
IIIA | Al |
|
IVA | Si |
|
VA | P |
|
VIA | O |
|
VIIA | Br |
|
VIIIA | Ne |
|
Trả lời câu hỏi 1 sgk trang 49:
Nguyên tử fluorine có cấu hình [He]2s$^{2}$2p$^{5}$ và electron hóa trị được biểu diễn là: Khi nhận thêm 1 electron thì trở thành [He] 2s$^{2}$2p$^{6}$ là cấu hình của nguyên tử Ne.
Trả lời câu hỏi 2 sgk trang 49:
Để giảm năng lượng, các nguyên tử kết hợp lại theo xu hướng đạt tới cấu hình bền vững của khí hiếm (theo quy tắc octet).
II. QUY TẮC OCTET
Khi hình thành liên kết hóa học, nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm. => Quy tắc octet
Trong phân tử Cl$_{2}$, nguyên tử Cl có 7 electron hóa trị, mỗi nguyên tử Cl cần thêm 1 electron để đạt cấu hình bão hòa theo quy tắc octet nên mỗi nguyên tử chlorine góp chung 1 electron.
Trong phân tử NaCl, nguyên tử Na có 1 electron hóa trị, nguyên tử F có 7 electron hóa trị, nguyên tử Na nhường 1 electron hóa trị tạo thành các hạt mang điện tích dương, nguyên tử F nhân 1 electron tạo thành hạt mang điện tích âm. Các hạt này đều đạt octet và hút nhau bằng lực hút tĩnh điện.
VD đề xuất cấu hình electron:
Br$_{2}$:

C$_{2}$H$_{6}$:
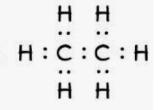
Dự đoán: liên kết cộng hóa trị xảy ra khi cả các nguyên tố liên kết với nhau đều là nguyên tố nhận electron (phi kim). Liên kết ion xảy ra khi có các nguyên tố nhận electron kết hợp với nguyên tố cho electron (tức là nguyên tố kim loại điển hình liên kết với nguyên tố phi kim điển hình).
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây

Bình luận