Dễ hiểu giải Hóa học 12 Kết nối tri thức bài 24: Nguyên tố nhóm IA
Giải dễ hiểu bài 24: Nguyên tố nhóm IA. Trình bày rất dễ hiểu, nên tiếp thu Hóa học 12 Kết nối dễ dàng. Học sinh nắm được kiến thức và biết suy rộng ra các bài tương tự. Thêm 1 dạng giải mới để mở rộng tư duy. Danh mục các bài giải trình bày phía dưới
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 24. NGUYÊN TỐ NHÓM IA
MỞ ĐẦU
Các kim loại nhóm IA (nhóm kim loại kiềm) và hợp chất của chúng có nhiều ứng dụng như: sản xuất pin lithium, nước Javel, phân kali, tế bào quang điện, đồng hồ nguyên tử,…
Vậy, đơn chất nhóm IA có đặc điểm gì nổi bật về tính chất vật lí và tính chất hóa học? Các hợp chất nhóm IA quan trọng như xút, soda được sản xuất trong công nghiệp như thế nào?
Giải nhanh:
- TCVL: mềm, khối lượng riêng nhỏ, nhiệt độ nóng chảy và nhiệt độ sôi thấp.
- TCHH: tính khử mạnh, mức độ phản ứng với nước, chlorine và oxygen tăng dần trong dãy lithium, sodium, potassium.
- Xút: quá trình điện phân dung dịch NaCl.
- Soda: phương pháp Solvay
I. ĐƠN CHẤT NHÓM IA
Hoạt động nghiên cứu: Một số đại lượng đặc trưng của các nguyên tố nhóm IA được trình bày trong Bảng 24.1.
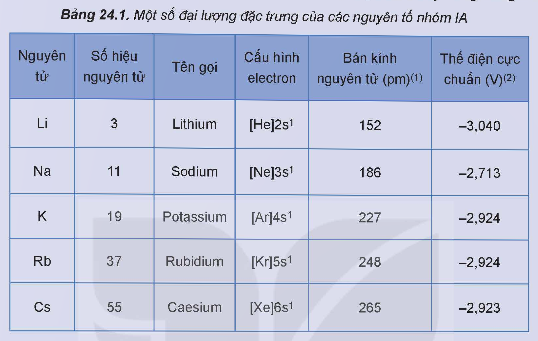
Thực hiện các yêu cầu sau:
1. Nhận xét về xu hướng biến đổi bán kính nguyên tử của nguyên tố nhóm IA.
2. Cho biết xu hướng biến đổi tính khử từ Li đến Cs, số oxi hóa đặc trưng của nguyên tử kim loại nhóm IA.
Giải nhanh:
1. Tăng dần từ Li đến Cs.
2. Tính khử giảm dần từ Li đến Cs. Số oxi hoá đặc trưng là +1.
Câu hỏi 1: Tại sao các nguyên tố kim loại nhóm IA không tồn tại ở dạng đơn chất trong tự nhiên?
Giải nhanh:
Vì các nguyên tố kim loại này đều là những kim loại hoạt động rất mạnh. Khi ở ngoài môi trường không khí, chúng tác dụng với các chất ở môi trường xung quanh tạo thành hợp chất.
Hoạt động nghiên cứu: Một số thông số vật lí của kim loại nhóm IA được trình bày ở Bảng 24.2.

Thực hiện các yêu cầu sau:
1. Nhận xét về xu hướng biến đổi nhiệt độ nóng chảy, nhiệt độ sôi của các kim loại nhóm IA.
2. Dựa vào Bảng 24.2, hãy nhận xét về khối lượng riêng và độ cứng của các kim loại nhóm IA.
Giải nhanh:
1. Từ Li đến Cs, nhiệt độ nóng chảy và nhiệt độ sôi giảm dần.
2. Khối lượng riêng tăng dần từ Li đến Cs, độ cứng giảm dần từ Li đến Cs.
Hoạt động nghiên cứu: Lithium, sodium, potassium tác dụng với nước, chlorine, oxygen
Ba thí nghiệm về phản ứng của lithium, sodium, potassium với nước, chlorine, oxygen đã được thực hiện và quan sát thấy các hiện tượng như được mô tả dưới đây:
Hóa chất: kim loại lithium, sodium, potassium, nước.
Dụng cụ: 3 bình tam giác đựng khí oxygen, 3 bình tam giác đựng khí chlorine, 3 chậy thủy tinh, muôi sắt, dao, kẹp sắt.
Thí nghiệm 1: Tác dụng với nước
Tiến hành:
Cho mỗi mẩu kim loại vào một chậu thủy tinh chứa nước, hiện tượng xảy ra được ghi lại ở Bảng 24.3.

Thực hiện các yêu cầu sau:
1. So sánh mức độ phản ứng của Li, Na, K với nước.
2. Viết phương trình hóa học của các phản ứng xảy ra. Nêu cách nhận biết môi trường của các dung dịch sau phản ứng.
Thí nghiệm 2: Tác dụng với chlorine
Tiến hành:
Cho mỗi mẩu kim loại Li, Na, K vào một muôi sắt, hơ nóng trên ngọn lửa đèn cồn đến khi nóng chảy, rồi đưa nhanh vào bình đựng khí chlorine.
Hiện tượng xảy ra như sau: Các kim loại bốc cháy với mức độ tăng dần từ Li đến K.
Thực hiện yêu cầu sau:
Viết phương trình hóa học của các phản ứng xảy ra.
Thí nghiệm 3: Tác dụng với oxygen
Tiến hành:
Cho mỗi mẩu kim loại Li, Na, K vào một muôi sắt, hơ nóng trên ngọn lửa đèn cồn đến khi nóng chảy rồi đưa nhanh vào bình đựng khí oxygen.
Hiện tượng xảy ra như sau: Các kim loại bốc cháy với mức độ tăng dần từ Li đến K.
Thực hiện yêu cầu sau:
Viết phương trình hóa học của các phản ứng xảy ra.
Giải nhanh:
- TN1:
1. Từ Li đến K, mức độ phản ứng với nước tăng dần.
2. PTHH: 2Li + 2H2O → 2LiOH + H2
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
Dùng phenolphthalein vì dung dịch sẽ chuyển sang màu hồng hoặc dùng quỳ tím vì dung dịch làm giấy quỳ chuyển xanh
- TN2: PTHH:
2Li + Cl2 ![]() 2LiCl
2LiCl
2Na + Cl2 ![]() 2NaCl
2NaCl
2K + Cl2 ![]() 2KCl
2KCl
- TN3: PTHH
4Li + O2 ![]() 2Li2O
2Li2O
4Na + O2 ![]() 2Na2O
2Na2O
4K + O2 ![]() 2K2O
2K2O
Câu hỏi 2: Trong phòng thí nghiệm:
a) Khi cho kim loại nhóm IA (Li, Na, K) tác dụng với nước thì cần lấy mẩu kim loại nhỏ. Giải thích.
b) Sodium được dùng để loại nước khỏi một số dung môi hữu cơ như ether. Giải thích.
Giải nhanh:
a) Vì để nhiệt lượng toả ra ít, mức độ phản ứng vừa phải, có thể kiểm soát án toàn.
b) Sodium có khả năng phản ứng với các vết nước có lẫn trong ether và không phản ứng với ether.
Câu hỏi 3:
a) Tại sao có thể bảo quản Na, K bằng cách ngâm trong dầu hỏa?
b) Có thể sử dụng các alcohol (ví dụ ethanol) để bảo quản kim loại nhóm IA không? Giải thích.
Giải nhanh:
a) Vì miếng kim loại chìm trong dầu nên hạn chế khả năng tiếp xúc giữa km loại với oxygen và hơi ẩm trong không khí
b) Không vì các alcohol có phản ứng với kim loại kiềm.
II. HỢP CHẤT CỦA KIM LOẠI NHÓM IA
 Hoạt động nghiên cứu: Phân biệt các ion Li+, Na+, K+ bằng nàu ngọn lửa (học sinh quan sát video thí nghiệm)
Hoạt động nghiên cứu: Phân biệt các ion Li+, Na+, K+ bằng nàu ngọn lửa (học sinh quan sát video thí nghiệm)
Hóa chất: các dung dịch bão hòa: LiCl, NaCl, KCl.
Dụng cụ: ống nghiệm, giá ống nghiệm; dây platinum (hoặc nickel); đèn khí Bunsen (khí gas).
Tiến hành:
- Nhúng dây platinum vào ống nghiệm chứa dung dịch LiCl bão hòa.
- Hơ nóng đầu dây trên ngọn lửa đèn khí.
- Tiến hành thí nghiệm tương tự với dung dịch NaCl bão hòa và dung dịch KCl bão hòa.
Quan sát hiện tượng xảy ra qua video thí nghiệm và thực hiện yêu cầu sau:
Nhận xét về màu ngọn lửa các ion kim loại trong thí nghiệm.
Giải nhanh:
- Ion Li+ có màu đỏ tía.
- Ion Na+ có màu vàng.
- Ion K+ có màu tím nhạt.
Hoạt động nghiên cứu: Viết các quá trình oxi hóa, quá trình khử xảy ra ở mỗi điện cực và viết phương trình hóa học của quá trình điện phân dung dịch NaCl có màng ngăn.
Giải nhanh:
- Tại anode, quá trình oxi hoá: 2Cl- → Cl2 + 2e
- Tại cathode, quá trình khử: 2H2O + 2e → H2 + 2OH-
Hoạt động nghiên cứu: NaHCO3 là hợp chất kém bền nhiệt, bắt đầu bị phân hủy ở khoảng 120 oC:
2NaHCO3(s) ![]() Na2CO3(s) + CO2(g) + H2O(g)
Na2CO3(s) + CO2(g) + H2O(g)
Trong thực tiễn, NaHCO3 được sử dụng làm bột nở trong chế biến thực phẩm và làm chất chữa cháy dạng bột. Giải thích cơ sở của các ứng dụng đó.
Giải nhanh:
- NaHCO3 làm bột nổ vì dễ bị phân huỷ trong quá trình nấu nướng và quá trình phân huỷ sinh ra khí và hơi tạo nhiều lỗ xốp.
- NaHCO3 làm chất chữa cháy dạng bột vì dễ bị phân huỷ, quá trình phân huỷ kèm thu nhiệt (làm giảm nhiệt độ đám cháy) và sinh ra khó và hơi (pha loãng oxygen, giảm tốc độ phản ứng cháy).
Hoạt động nghiên cứu: Viết các phương trình hóa học để giải thích cơ sở các ứng dụng sau:
a) Viên sủi chứa NaHCO3 và acid hữu cơ (viết gọn là HX) có khả năng tạo bọt khí khi hòa tan vào nước.
b) Trong kĩ thuật xử lí nước, NaHCO3 được sử dụng để điều chỉnh pH khi nước dư acid (H+).
Giải nhanh:
a) NaHCO3 + HX → NaX + CO2 + H2O
b) NaHCO3 + H+ → Na+ + CO2 + H2O
![]()
Hoạt động nghiên cứu: Trong thực tiễn, sodium carbonate có một số ứng dụng:
1. Tách kim loại ion Mg2+ và Ca2+ ra khỏi nước (để làm mềm nước).
2. Tách kim loại ion Fe3+ ra khỏi nước ở dạng kết loại Fe(OH)3 (để xử lí nước nhiễm phèn).
Viết phương trình hóa học để giải thích các ứng dụng trên.
Giải nhanh:
1. Na2CO3 + Mg2+ → MgCO3↓ + 2Na+
Na2CO3 + Ca2+ → CaCO3↓ + 2Na+
2. 3Na2CO3 + Fe3+ + H2O → Fe(OH)3↓ + 6Na+ + 3CO2↑
Câu hỏi 4:
a) Trong quá trình Solvay, viết các phương trình hóa học của phản ứng:
- Nung vôi để cung cấp vôi sống và carbon dioxide.
- Tái chế ammonia từ vôi sống và dung dịch ammonium chloride.
b) Quy trình Solvay đã giảm thiểu được tác động đến môi trường bằng cách quay vòng các sản phẩm trung gian (như CO2 và NH3) để tái sử dụng trong quy trình sản xuất.
Từ sơ đồ quá trình Solvay, hãy làm sáng tỏ nhận định trên.
Giải nhanh:
a) - Nung vôi: CaCO3 ![]() CaO + CO2
CaO + CO2
- Tái chế ammonia:
+ Từ vôi sống: CaO + NH4Cl → CaCl2 + NH3 + H2O
+ Từ dung dịch ammonium chloride: NH4Cl ![]() NH3 + HCl
NH3 + HCl
b) Trong quy trình Solvay, các sản phẩm đều được thu hồi và tái chế quay trở lại dây chuyền sản xuất nên hạn chế tác động đối với môi trường.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
Giải bài tập những môn khác
Môn học lớp 12 KNTT
5 phút giải toán 12 KNTT
5 phút soạn bài văn 12 KNTT
Văn mẫu 12 KNTT
5 phút giải vật lí 12 KNTT
5 phút giải hoá học 12 KNTT
5 phút giải sinh học 12 KNTT
5 phút giải KTPL 12 KNTT
5 phút giải lịch sử 12 KNTT
5 phút giải địa lí 12 KNTT
5 phút giải CN lâm nghiệp 12 KNTT
5 phút giải CN điện - điện tử 12 KNTT
5 phút giải THUD12 KNTT
5 phút giải KHMT12 KNTT
5 phút giải HĐTN 12 KNTT
5 phút giải ANQP 12 KNTT
Môn học lớp 12 CTST
5 phút giải toán 12 CTST
5 phút soạn bài văn 12 CTST
Văn mẫu 12 CTST
5 phút giải vật lí 12 CTST
5 phút giải hoá học 12 CTST
5 phút giải sinh học 12 CTST
5 phút giải KTPL 12 CTST
5 phút giải lịch sử 12 CTST
5 phút giải địa lí 12 CTST
5 phút giải THUD 12 CTST
5 phút giải KHMT 12 CTST
5 phút giải HĐTN 12 bản 1 CTST
5 phút giải HĐTN 12 bản 2 CTST
Môn học lớp 12 cánh diều
5 phút giải toán 12 CD
5 phút soạn bài văn 12 CD
Văn mẫu 12 CD
5 phút giải vật lí 12 CD
5 phút giải hoá học 12 CD
5 phút giải sinh học 12 CD
5 phút giải KTPL 12 CD
5 phút giải lịch sử 12 CD
5 phút giải địa lí 12 CD
5 phút giải CN lâm nghiệp 12 CD
5 phút giải CN điện - điện tử 12 CD
5 phút giải THUD 12 CD
5 phút giải KHMT 12 CD
5 phút giải HĐTN 12 CD
5 phút giải ANQP 12 CD
Giải chuyên đề học tập lớp 12 kết nối tri thức
Giải chuyên đề Ngữ văn 12 Kết nối tri thức
Giải chuyên đề Toán 12 Kết nối tri thức
Giải chuyên đề Vật lí 12 Kết nối tri thức
Giải chuyên đề Hóa học 12 Kết nối tri thức
Giải chuyên đề Sinh học 12 Kết nối tri thức
Giải chuyên đề Kinh tế pháp luật 12 Kết nối tri thức
Giải chuyên đề Lịch sử 12 Kết nối tri thức
Giải chuyên đề Địa lí 12 Kết nối tri thức
Giải chuyên đề Tin học ứng dụng 12 Kết nối tri thức
Giải chuyên đề Khoa học máy tính 12 Kết nối tri thức
Giải chuyên đề Công nghệ 12 Điện - điện tử Kết nối tri thức
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Kết nối tri thức
Giải chuyên đề học tập lớp 12 chân trời sáng tạo
Giải chuyên đề Ngữ văn 12 Chân trời sáng tạo
Giải chuyên đề Toán 12 Chân trời sáng tạo
Giải chuyên đề Vật lí 12 Chân trời sáng tạo
Giải chuyên đề Hóa học 12 Chân trời sáng tạo
Giải chuyên đề Sinh học 12 Chân trời sáng tạo
Giải chuyên đề Kinh tế pháp luật 12 Chân trời sáng tạo
Giải chuyên đề Lịch sử 12 Chân trời sáng tạo
Giải chuyên đề Địa lí 12 Chân trời sáng tạo
Giải chuyên đề Tin học ứng dụng 12 Chân trời sáng tạo
Giải chuyên đề Khoa học máy tính 12 Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Điện - điện tử Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Chân trời sáng tạo
Giải chuyên đề học tập lớp 12 cánh diều
Giải chuyên đề Ngữ văn 12 Cánh diều
Giải chuyên đề Toán 12 Cánh diều
Giải chuyên đề Vật lí 12 Cánh diều
Giải chuyên đề Hóa học 12 Cánh diều
Giải chuyên đề Sinh học 12 Cánh diều
Giải chuyên đề Kinh tế pháp luật 12 Cánh diều
Giải chuyên đề Lịch sử 12 Cánh diều
Giải chuyên đề Địa lí 12 Cánh diều
Giải chuyên đề Tin học ứng dụng 12 Cánh diều
Giải chuyên đề Khoa học máy tính 12 Cánh diều
Giải chuyên đề Công nghệ 12 Điện - điện tử Cánh diều
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Cánh diều

Bình luận