Soạn giáo án điện tử KHTN 7 kết nối bài 6: Giới thiệu về liên kết hóa học
Giáo án powerpoint khoa học tự nhiên 7 kết nối tri thức mới bài bài 6: Giới thiệu về liên kết hóa học. Giáo án soạn theo tiêu chí hiện đại, đẹp mắt với nhiều hình ảnh, nội dung, hoạt động phong phú, sáng tạo. Giáo án điện tử này dùng để giảng dạy online hoặc trình chiếu. Tin rằng, bộ bài giảng này sẽ hỗ trợ tốt việc giảng dạy và đem đến sự hài lòng với thầy cô.








Còn nữa....Giáo án khi tải về là bản đầy đủ. Có full siles bài giảng!
Nội dung giáo án
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC NGÀY HÔM NAY!
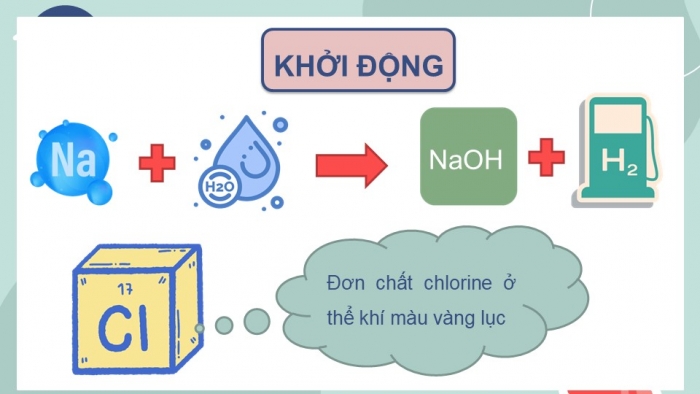
KHỞI ĐỘNG
Đơn chất chlorine ở thể khí màu vàng lục
Vậy thứ gì giữ các nguyên tử lại với nhau ở dạng “kết hợp”? Có những dạng “kết hợp” nào giữa các nguyên tử?
BÀI 6: GIỚI THIỆU VỀ LIÊN KẾT HÓA HỌC
NỘI DUNG BÀI HỌC
Cấu trúc electron bền vững của khí hiếm
Liên kết ion
Liên kết cộng hóa trị
- Cấu trúc electron bền vững của khí hiếm
Đọc mục I. Cấu trúc electron bền vững của khí hiếm và trả lời câu hỏi:
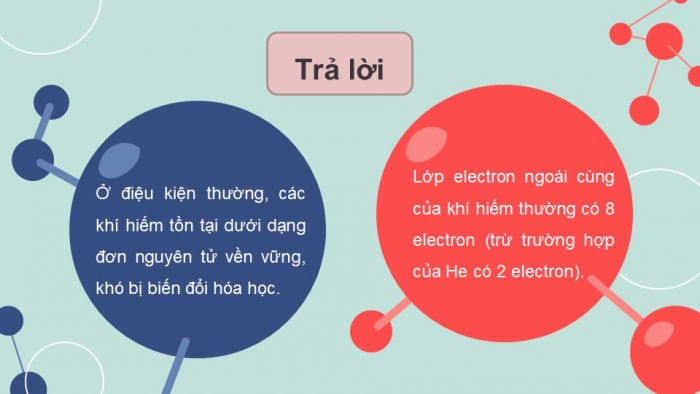
Vì sao khí hiếm lại có cấu trúc electron bền vững?
Trả lời
Ở điệu kiện thường, các khí hiếm tồn tại dưới dạng đơn nguyên tử vền vững, khó bị biến đổi hóa học.
Lớp electron ngoài cùng của khí hiếm thường có 8 electron (trừ trường hợp của He có 2 electron).
Trả lời
Nguyên tử của các nguyên tố khác có xu hướng tham gia liên kết hóa học để đạt lớp ngoài cùng giống khí hiếm.
- Nhường electron
- Nhận electron
- Dùng chung electron.
Thảo luận nhóm đôi
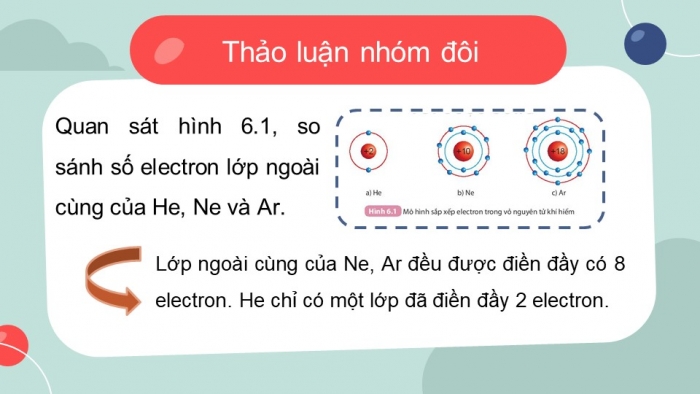
Quan sát hình 6.1, so sánh số electron lớp ngoài cùng của He, Ne và Ar.
Lớp ngoài cùng của Ne, Ar đều được điền đầy có 8 electron. He chỉ có một lớp đã điền đầy 2 electron.
Liên kết ion
Sự hình thành liên kết ion trong phân tử muối ăn.
- Khi hình thành phân tử sodium chloride (NaCl):
- Nguyên tử natri (Na) nhường một electron ở lớp electron ngoài cùng cho nguyên tử chlorine (Cl) để tạo thành ion dương Na+ có vỏ bền vững giống vỏ nguyên tử khí hiếm Ne.
- Nguyên tử Cl nhận vào lớp electron ngoài cùng một electron của nguyên tử Na để tạo thành ion âm Cl- có vỏ bền vững giống vỏ nguyên tử khí hiểm Ar.
- Hai ion được tạo thành mang điện tích ngược dấu hút nhau để hình thành liên kết ion trong phân tử muối ăn.
Thảo luận
Câu 1: Quan sát Hình 6.2 và so sánh số electron ở lớp ngoài cùng của nguyên tử Na, Cl với ion Na+ ,Cl-.
- Số electron ở lớp ngoài cùng của nguyên tử Na (trước khi tạo thành liên kết ion): 1; số electron ở lớp ngoài cùng của ion Na+ (sau khi tạo thành liên kết ion): 8.
- Số electron ở lớp ngoài cùng của Cl trước khi tạo thành liên kết ion: 7, sau khi tạo thành liên kết ion: 8.
Câu 2: Cho sơ đồ mô tả sự hình thành liên kết ion trong phân tử magnesium oxide như sau:
Hãy cho biết nguyên tử Mg đã nhường hay nhận bao nhiêu electron.
Nguyên tử Mg đã nhường 2 electron.
III. Liên kết cộng hóa trị
- Liên kết cộng hóa trị trong phân tử đơn chất
Sự hình thành phân tử hydrogen.
Khi hình thành phân tử, mỗi nguyên tử H đã góp chung 1 electron tạo thành một cặp electron dùng chung.
Sự hình thành phân tử oxygen.
- Khi hình thành phân tử, mỗi nguyên tử O đã góp chung 2 electron tạo thành 2 cặp electron dùng chung.
- Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung.
- Liên kết được hình thành trong phân tử hydrogen và oxygen là liên kết cộng hóa trị.
Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung, thường gặp trong nhiều phân tử đơn chất phi kim như nitrogen, chlorine, flourine,..
Giáo án điện tử khoa học tự nhiên 7 kết nối tri thức, giáo án powerpoint khoa học tự nhiên 7 KNTT bài 6: Giới thiệu về liên kết hóa, bài giảng điện tử khoa học tự nhiên 7 Kết nối
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
