Câu hỏi tự luận mức độ vận dụng Hóa học 12 ctst bài 19: Đại cương về kim loại
3. VẬN DỤNG (7 CÂU)
Câu 1: Nhúng một lá sắt vào dung dịch đồng sulfate sau một thời gian lấy lá sắt ra khỏi dung dịch cân lại thấy nặng hơn ban đầu 0,4g. Khối lượng đồng bám vào lá sắt là bao nhiêu?
Câu 2: Cho 22,4g Fe tác dụng vừa đủ với 200g dung dịch H2SO4 loãng. Nồng độ % của dung dịch acid đã phản ứng là bao nhiêu?
Câu 3: Dẫn khí CO quan m gam bột Fe2O3 nung nóng, sau một thời gian thu được 24 gam chất rắn X và hỗn hợp khí Y. Dẫn khí Y vào dung dịch nước vôi trong dư thu được 30 gam kết tủa. Tính m.
Câu 4: Hòa tan hết 2,16 gam hỗn hợp Cr và Fe trong dung dịch HCl đun nóng thu được 896 ml khí ở đktc. Khối lượng crom trong hỗn hợp ban đầu là bao nhiêu?
Câu 5: Cho 10,8 g hỗn hợp Cr và Fe tác dụng hoàn toàn với dung dịch HCl nóng, dư thu được 4,48 lít khí (đktc). Tổng khối lượng muối thu được trong dung dịch sau phản ứng là bao nhiêu?
Câu 6: Cho luồng khí CO (dư) đi qua 4,8 gam hỗn hợp X gồm CuO và Fe2O3 (tỉ lệ mol là 1:1) nung nóng đến khi phản ứng hoàn toàn, thu được m gam chất rắn. Tính m.
Câu 7: Hoà tan hoàn toàn hỗn hợp gồm 0,03 mol Cu và 0,09 mol Mg vào dung dịch chứa 0,07 mol KNO3 và 0,16 mol H2SO4 loãng thì thu được dung dịch chỉ chứa các muối sulfate trung hoà và 1,12 lít khí (đktc) hỗn hợp X gồm các oxide của nitrogen có tỉ khối so với H2 là x. Tính x.
Câu 1:
Fe + CuSO4 → FeSO4 + Cu
x x mol
Khối lượng lá sắt tăng = mCu sinh ra – mFe phản ứng
→ 64x – 56x = 0,4 → x = 0,05 mol
mCu sinh ra = 64.0,05 = 3,2 gam.
Câu 2:
nFe = 22,4 : 56 = 0,4 mol
Fe + H2SO4 → FeSO4 + H2
0,4 → 0,4 mol
macid = 0,4.98 = 39,2 gam.
C% = 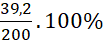 = 19,6%
= 19,6%
Câu 3:
3CO + Fe2O3 → 2Fe + 3CO2
0,3 0,3 mol
CO2 + Ca(OH)2 dư → CaCO3 (↓) + H2O
0,3 0,3 mol
Bảo toàn khối lượng có: mCO pư + mFe2O3 = mCO2 + mX
→ 0,3.28 + m = 0,3.44 + 24 → m = 28,8 gam.
Câu 4:
Gọi số mol của Cr và Fe lần lượt là x và y mol
→ 52x + 56y = 2,16
PTHH: Cr + 2HCl → CrCl2 + H2
x x
Fe + 2HCl → FeCl2 + H2
y y
nkhí = x + y = 0,04
Giải hệ phương trình được x = y = 0,02.
Vậy mCr = 0,02.52 = 1,04 gam.
Câu 5:
Bảo toàn H có nHCl = 2.nkhí = 2.0,2 = 0,4 mol
Áp dụng định luật bảo toàn khối lượng ta có:
mkim loại + macid = mmuối + mkhí → mmuối = 10,8 + 0,4.36,5 – 0,2.2 = 25 gam.
Câu 6:
Gọi số mol của CuO và Fe2O3 là a mol
Ta có:
a = 4,8:(80+160) = 0,02 mol.
Phương trình hóa học:
CuO + CO → Cu + CO2
0,02 → 0,02
Fe2O3 + 3CO → 2Fe + 2CO2
0,02 →→ 0,04
→ mchất rắn = mCu + mFe = 0,02.64 + 0,04.56 = 3,52 gam
Câu 7:
X chỉ chứa các muối trung hoà gồm Cu2+, Mg2+, K+, SO42- và NH4+ (nếu có).
Bảo toàn điện tích: 2.0,03 + 2.0,09 + 0,07 + nNH4 = 0,16.2
=> nNH4 = 0,01 mol.
Bảo toàn H: 2nH2O = 2nH2SO4 – 4nNH4 = 0,28 nên số mol H2O là 0,14 mol.
Bảo toàn khối lượng: mkim loại + mKNO3 + mH2SO4 – mH2O – mion muối = mkhí
mkhí = 1,96 gam => Mkhí = 39,2 g/mol => dkhí/H2 = 19,6.
Giải những bài tập khác
Giải bài tập những môn khác
Môn học lớp 12 KNTT
5 phút giải toán 12 KNTT
5 phút soạn bài văn 12 KNTT
Văn mẫu 12 KNTT
5 phút giải vật lí 12 KNTT
5 phút giải hoá học 12 KNTT
5 phút giải sinh học 12 KNTT
5 phút giải KTPL 12 KNTT
5 phút giải lịch sử 12 KNTT
5 phút giải địa lí 12 KNTT
5 phút giải CN lâm nghiệp 12 KNTT
5 phút giải CN điện - điện tử 12 KNTT
5 phút giải THUD12 KNTT
5 phút giải KHMT12 KNTT
5 phút giải HĐTN 12 KNTT
5 phút giải ANQP 12 KNTT
Môn học lớp 12 CTST
5 phút giải toán 12 CTST
5 phút soạn bài văn 12 CTST
Văn mẫu 12 CTST
5 phút giải vật lí 12 CTST
5 phút giải hoá học 12 CTST
5 phút giải sinh học 12 CTST
5 phút giải KTPL 12 CTST
5 phút giải lịch sử 12 CTST
5 phút giải địa lí 12 CTST
5 phút giải THUD 12 CTST
5 phút giải KHMT 12 CTST
5 phút giải HĐTN 12 bản 1 CTST
5 phút giải HĐTN 12 bản 2 CTST
Môn học lớp 12 cánh diều
5 phút giải toán 12 CD
5 phút soạn bài văn 12 CD
Văn mẫu 12 CD
5 phút giải vật lí 12 CD
5 phút giải hoá học 12 CD
5 phút giải sinh học 12 CD
5 phút giải KTPL 12 CD
5 phút giải lịch sử 12 CD
5 phút giải địa lí 12 CD
5 phút giải CN lâm nghiệp 12 CD
5 phút giải CN điện - điện tử 12 CD
5 phút giải THUD 12 CD
5 phút giải KHMT 12 CD
5 phút giải HĐTN 12 CD
5 phút giải ANQP 12 CD
Giải chuyên đề học tập lớp 12 kết nối tri thức
Giải chuyên đề Ngữ văn 12 Kết nối tri thức
Giải chuyên đề Toán 12 Kết nối tri thức
Giải chuyên đề Vật lí 12 Kết nối tri thức
Giải chuyên đề Hóa học 12 Kết nối tri thức
Giải chuyên đề Sinh học 12 Kết nối tri thức
Giải chuyên đề Kinh tế pháp luật 12 Kết nối tri thức
Giải chuyên đề Lịch sử 12 Kết nối tri thức
Giải chuyên đề Địa lí 12 Kết nối tri thức
Giải chuyên đề Tin học ứng dụng 12 Kết nối tri thức
Giải chuyên đề Khoa học máy tính 12 Kết nối tri thức
Giải chuyên đề Công nghệ 12 Điện - điện tử Kết nối tri thức
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Kết nối tri thức
Giải chuyên đề học tập lớp 12 chân trời sáng tạo
Giải chuyên đề Ngữ văn 12 Chân trời sáng tạo
Giải chuyên đề Toán 12 Chân trời sáng tạo
Giải chuyên đề Vật lí 12 Chân trời sáng tạo
Giải chuyên đề Hóa học 12 Chân trời sáng tạo
Giải chuyên đề Sinh học 12 Chân trời sáng tạo
Giải chuyên đề Kinh tế pháp luật 12 Chân trời sáng tạo
Giải chuyên đề Lịch sử 12 Chân trời sáng tạo
Giải chuyên đề Địa lí 12 Chân trời sáng tạo
Giải chuyên đề Tin học ứng dụng 12 Chân trời sáng tạo
Giải chuyên đề Khoa học máy tính 12 Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Điện - điện tử Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Chân trời sáng tạo
Giải chuyên đề học tập lớp 12 cánh diều
Giải chuyên đề Ngữ văn 12 Cánh diều
Giải chuyên đề Toán 12 Cánh diều
Giải chuyên đề Vật lí 12 Cánh diều
Giải chuyên đề Hóa học 12 Cánh diều
Giải chuyên đề Sinh học 12 Cánh diều
Giải chuyên đề Kinh tế pháp luật 12 Cánh diều
Giải chuyên đề Lịch sử 12 Cánh diều
Giải chuyên đề Địa lí 12 Cánh diều
Giải chuyên đề Tin học ứng dụng 12 Cánh diều
Giải chuyên đề Khoa học máy tính 12 Cánh diều
Giải chuyên đề Công nghệ 12 Điện - điện tử Cánh diều
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Cánh diều

Bình luận