Đề thi cuối kì 2 Hóa học 10 KNTT: Đề tham khảo số 8
Trọn bộ Đề thi cuối kì 2 Hóa học 10 KNTT: Đề tham khảo số 8 bộ sách mới Kết nối tri thức gồm nhiều câu hỏi ôn tập hay, các dạng bài tập phong phú giúp các em củng cố ôn luyện lại kiến thức thật tốt chuẩn bị tốt cho kì thi sắp tới. Tài liệu có kèm theo đáp án và lời giải chi tiết. Hi vọng đây sẽ là tài liệu hữu ích giúp các em đạt điểm cao. Thầy cô và các em kéo xuống để tham khảo ôn luyện
PHÒNG GD & ĐT ………………. | Chữ kí GT1: ........................... |
TRƯỜNG THPT………………. | Chữ kí GT2: ........................... |
ĐỀ KIỂM TRA HỌC KÌ 2
HÓA 10 – KẾT NỐI TRI THỨC
NĂM HỌC: 2022 – 2023
Thời gian làm bài: 45 phút (Không kể thời gian phát đề)
Họ và tên: …………………………………… Lớp: ……………….. Số báo danh: …………………………….……Phòng KT:………….. | Mã phách |
"
Điểm bằng số
| Điểm bằng chữ | Chữ ký của GK1 | Chữ ký của GK2 | Mã phách |
A. PHẦN TRẮC NGHIỆM (7 điểm)
Khoanh tròn vào chữ cái đứng trước câu trả lời đúng:
Câu 1: Trong đơn chất, số oxi hóa của nguyên tử bằng
A. 0.
B. -1.
C. +3.
D. -3.
Câu 2: Số oxi hóa của nguyên tử S trong hợp chất SO2 là
A. +2
B. +4
C. +6.
D. -1
Câu 3: Phản ứng oxi hóa - khử là phản ứng xảy ra đồng thời quá trình nhường và nhận
A. electron
B. neutron
C. proton
D. cation
Câu 4: Cho phản ứng oxi hóa khử sau:
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Trong phản ứng này chất khử là
A. Cu
B. Fe(NO3)3
C. Fe
D. Cu(NO3)3
Câu 5: Phản ứng hấp thu năng lượng dưới dạng nhiệt được gọi là
A. Phản ứng cháy
B. Phản ứng tỏa nhiệt
C. Phản ứng oxi hóa - khử
D. Phản ứng thu nhiệt
Câu 6: Cho phương trình nhiệt học sau:
2H2 + O2 → 2H2O 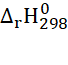 = -571,6 kJ
= -571,6 kJ
Nhận xét nào sau đây là đúng?
A. Phản ứng đốt cháy 2 mol khí hydrogen bằng 1 mol khí oxygen, tạo thành 2 mol nước ở trạng thái lỏng thu vào nhiệt lượng 571,6 kJ
B. Phản ứng đốt chát 2 mol khí hydrogen bằng 1 mol oxygen, tạo thành 2 mol nước ở trạng thái lỏng tỏa ra nhiệt lượng 571,6 kJ.
C. Phản ứng tạo thành 1 mol nước ở trạng thái lỏng thu vào nhiệt lượng 571,6 kJ
D. Phản ứng tạo thành 1 mol nước ở trạng thái lỏng tỏa ra nhiệt lượng 571,6 kJ
Câu 7: Điều kiện áp suất 1 bar đối với chất khí, nồng độ 1 mol/ lít đối với chất tan trong dung dịch và nhiệt độ 25oC hay 298k được gọi là
A. Điều kiện chuẩn
B. Điều kiện tiêu chuẩn
C. Điều kiện an toàn
D. Điều kiện thí nghiệm
Câu 8: Cho phương trình hóa học sau:
N2 (g) + 3H2(g) → 2NH3(g) 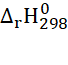 = -91,8 kJ
= -91,8 kJ
Biến thiên enthalpy chuẩn của phản ứng: 2NH3(g) → N2(g) + 3H2(g) là
A. -45,9 kJ.
B. +45,9 kJ.
C. – 91,8 kJ
D. +91,8 kJ.
Câu 9: Cho các chất sau, chất nào có nhiệt tạo thành chuẩn khác 0?
A. N2(g).
B. S(s).
C. Na(s).
D. O2(l).
Câu 10: Ở điều kiện chuẩn, công thức tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành là
A. ΔrH0298 = ΣEb(cd)+ΣEb(sp).
B. ΔrH0298 = ΣEb(cd)−ΣEb(sp).
C. ΔrH0298 = ΣEb(sp)−ΣEb(cd).
D. ΔrH0298 = ΣEb(sp)−ΣEb(cd).
Câu 11: Tốc độ phản ứng hoá học là
A. sự thay đổi nồng độ của một chất phản ứng trong một đơn vị thời gian.
B. sự thay đổi nồng độ của một sản phẩm phản ứng trong một đơn vị thời gian.
C. sự thay đổi lượng chất đầu hoặc chất sản phẩm trong một đơn vị thời gian.
D. sự thay đổi khối lượng của các chất đầu trong một đơn vị thời gian.
Câu 12: Việc làm nào dưới đây thể hiện sự ảnh hưởng của diện tích bề mặt đến tốc độ của phản ứng: Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g)
A. Pha loãng dung dịch HCl.
B. Thay sắt (iron) viên bằng sắt bột.
C. Sử dụng chất xúc tác.
D. Tăng nhiệt độ của phản ứng.
Câu 13: Khí oxygen được điều chế trong phòng thí nghiệm bằng cách nhiệt phân potassium chlorate. Để thí nghiệm thành công và rút ngắn thời gian tiến hành có thể dùng một số biện pháp sau:
(1) Dùng chất xúc tác manganese dioxide
(2) Nung ở nhiệt độ cao.
(3) Dùng phương pháp dời nước để thu được khí oxygen.
(4) Đập nhỏ potassium chlorte.
(5) Trộn đều bột potassium chlorate và xúc tác.
Số biện pháp dùng để tăng tốc độ phản ứng là
A.2
B. 3
C. 4
D. 5
Câu 14: Cho phản ứng đơn giản sau: 2NO + O2 → 2NO2. Mối liên hệ giữa tốc độ phản ứng và nồng độ các chất tham gia phản ứng là
A. v=k.CNO.CO2.
B. v=k.2CNO.CO2.
C. v=k.C2NO.CO2.
D. v=2k.CNO.CO2.
Câu 15: Cho các phản ứng hoá học sau:
(1) N2(g) + 3H2(g) ![]() 2NH3(g)
2NH3(g)
(2) CO2(g) + Ca(OH)2(aq) → CaCO3(s) + H2O(l)
(3) SiO2(s) + CaO(s) → CaSiO3(s)
(4) BaCl2(aq) + H2SO4(aq) → BaSO4(s) + 2HCl(aq)
Áp suất ảnh hưởng đến tốc độ phản ứng nào?
A. (1)
B. (1) và (2)
C. (1) và 3)
D. (3) và (4)
Câu 16: Cho phương trình phản ứng tổng quát sau: A + B → C.
Tốc độ phản ứng tại một thời điểm được tính bằng biểu thức: v = k.CA.CB. Hằng số tốc độ k phụ thuộc vào
A. nồng độ của chất đầu.
B. nồng độ của chất sản phẩm.
C. nhiệt độ của phản ứng.
D. thời gian xảy ra phản ứng.
Câu 17: Nhận xét nào sau đây là đúng?
A. Khi nồng độ chất tan trong dung dịch tăng, tốc độ phản ứng tăng.
B. Với mọi phản ứng, khi tăng áp suất, tốc độ phản ứng tăng.
C. Chất xúc tác làm ức chế phản ứng.
D. Trong hỗn hợp khí, nồng độ mỗi khí tỉ lệ nghịch với áp suất của nó.
Câu 18: Cho bột Zn vào dung dịch HCl loãng. Sau đó đun nóng hỗn hợp này. Phát biểu nào sau đây không đúng?
A. Khí H2 thoát ra nhanh hơn.
B. Bột Zn tan nhanh hơn.
C. Nồng độ HCl giảm nhanh hơn.
D. Lượng muối thu được nhiều hơn.
Câu 19: Nguyên tố nào sau đây không thuộc nhóm halogen?
A. B.
B. F.
C. Br.
D. I.
Câu 20: Halogen nào sau đây, điều kiện thường ở trạng thái rắn?
A. Fluorine.
B. Bromine.
C. Iodine.
D. Chlorine.
Câu 21: Phương trình hoá học nào sau đây sai?
A. H2 + F2 → 2HF.
B. Fe + Cl2 ![]() FeCl2.
FeCl2.
C. Cl2 + H2O ⇌ HCl + HClO.
D. Br2 + 2NaI → 2NaBr + I2.
Câu 22: Nguyên tố nào sau đây có tính oxi hoá mạnh nhất?
A. Fluorine.
B. Chlorine.
C. Chromium.
D. Bromine.
Câu 23: Cho một lượng Br2 tác dụng với kim loại đồng (copper) sau phản ứng thấy thu được 11,2 gam muối. Khối lượng bromine tham gia phản ứng là
A. 4 gam.
B. 8 gam.
C. 6 gam.
D. 10 gam.
Câu 24: Trong các acid sau: HF, HCl, HBr, HI. Acid mạnh nhất là
A. HF.
B. HCl.
C. HBr.
D. HI.
Câu 25: Hóa chất dùng để phân biệt các dung dịch: HF, NaCl, KBr là
A. dung dịch HCl.
B. quỳ tím.
C. dung dịch AgNO3.
D. dung dịch BaCl2.
Câu 26: Chất nào sau đây được ứng dụng để khắc chữ lên thuỷ tinh?
A. Cl2.
B. HCl.
C. F2.
D. HF
Câu 27: Hòa tan 1,2 gam magnesium trong dung dịch HCl dư. Sau phản ứng thu được thể tích khí H2 ở điều kiện chuẩn là
A. 0,2479 lít.
B. 0,4958 lít.
C. 0,5678 lít.
D. 1,2395 lít.
Câu 28: Cho muối halide nào sau đây tác dụng với dung dịch H2SO4 đặc, nóng thì chỉ xảy ra phản ứng trao đổi?
A. KBr.
B. KI.
C. NaCl.
D. NaBr.
PHẦN TỰ LUẬN (3 điểm)
Câu 1 (1 điểm): Lập phương trình hoá học của các phản ứng oxi hoá – khử sau, chỉ rõ chất oxi hoá, chất khử:
a) NH3 + O2 → NO + H2O
b) FeO + HNO3 → Fe(NO3)3 + NO + H2O.
Câu 2 (0,5 điểm): Cho phản ứng nhiệt học sau:
4FeS2(s) + 11O2(g) → aFe2O3(s) + bSO2(g) ![]()
Tìm a, b và tính biến thiên enthalpy của phản ứng ở điều kiện chuẩn biết nhiệt tạo thành của các chất trong phản ứng được cho ở bảng sau:
Chất | FeS2(s) | O2(g) | Fe2O3(s) | SO2(g) |
| -177,9 | 0 | -825,5 | -296,8 |
Câu 3 (0,5 điểm): Cho 1,03 gam muối sodium halide (A) tác dụng với dung dịch AgNO3 dư thì thu được một kết tủa. Kết tủa sau khi phân huỷ hoàn toàn cho 1,08 gam silver (bạc). Xác định tên muối (A).
Câu 4 (1 điểm): Nung nóng một bình bằng thép có chứa 0,04 mol H2 và 0,04 mol Cl2 để thực hiện phản ứng, thu được 0,072 mol khí HCl.
Tính hiệu suất của phản ứng tạo thành HCl.
BÀI LÀM
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
|
%
TRƯỜNG THPT ........
HƯỚNG DẪN CHẤM KIỂM TRA HỌC KÌ 2 (2022 – 2023)
MÔN: HÓA HỌC 10– KẾT NỐI TRI THỨC
A. PHẦN TRẮC NGHIỆM: (7,0 điểm)
Mỗi câu trả lời đúng được 0,25 điểm.
1. A | 2. B | 3. A | 4. C | 5. D | 6. B | 7. A |
8. D | 9.D | 10. A | 11. C | 12.B | 13. C | 14. B |
15. B | 16.C | 17. A | 18. D | 19.A | 20. C | 21. B |
22. A | 23. B | 24. D | 25.C | 26. D | 27.D | 28. C |
B. PHẦN TỰ LUẬN: (3,0 điểm)
Câu | Nội dung đáp án | Biểu điểm |
Câu 1 (1 điểm) | NH3 + O2 → NO + H2O Chất oxi hóa O2, chất khử NH3
Phương trình hóa học được cân bằng 4NH3 + 5O2 → 4NO + 6H2O b) FeO + HNO3 → Fe(NO3)3 + NO + H2O. Chất oxi hóa HNO3, chất khử: FeO. Ta có:
Phương trình hóa học được cân bằng 3FeO + 10 HNO3 → 3Fe(NO3)3 + NO + 5H2O. |
1đ
|
Câu 2 (1 điểm) | a = 2; b = 8. 4FeS2(s) + 11O2(g) → 2Fe2O3(s) + 8SO2(g) Ta có:
|
1 đ
|
Câu 3 | Đặt công thức hoá học của muối (A) là: NaX. Ta có các phương trình: NaX + AgNO3 → AgX + NaNO3 2AgX → 2Ag + X2 Dựa vào phương trình hoá học ta có:
MX = 80. Vậy X là Br (bromine). Muối (A) là NaBr (sodium bromide) |
1đ |
| Phương trình hóa học:
Hiệu suất phản ứng là:
|
|
TRƯỜNG THPT .........
MA TRẬN ĐỀ KIỂM TRA HỌC KÌ 2 (2022 – 2023)
MÔN: HÓA HỌC 10 – KẾT NỐI TRI THỨC
CHỦ ĐỀ | MỨC ĐỘ | Tổng số câu |
Điểm số | ||||||||
Nhận biết | Thông hiểu | Vận dụng | VD cao | ||||||||
TL | TN | TL | TN | TL | TN | TL | TN | TL | TN | ||
PHẢN ỨNG OXI HÓA KHỬ |
| 2 |
| 2 |
|
|
|
|
| 4 | 1 |
NĂNG LƯỢNG HÓA HỌC |
| 4 |
| 2 |
|
| 1 |
| 1 | 6 | 2 |
TỐC ĐỘ PHẢN ỨNG HÓA HỌC |
| 4
|
| 4 |
|
|
|
|
|
8 |
2 |
NGUYÊN TỐ NHÓM VIIA |
| 6 |
| 4 | 1 |
| 1 |
| 2 | 10 | 5 |
Tổng số câu TN/TL | 0 | 16 | 0 | 12 | 1 | 0 | 1 | 0 | 3 | 28 | 10,0 |
Điểm số |
| 4 | 0 | 3 | 2 | 0 | 1 | 0 | 3 | 7 | 10 |
Tổng số điểm | 4 điểm 40% | 3 điểm 30% | 2 điểm 20% | 1 điểm 10% | 10 điểm 10 % | 10 điểm | |||||
Thêm kiến thức môn học
Đề thi Hóa học 10 Kết nối tri thức, trọn bộ đề thi Hóa học 10 Kết nối tri thức, Đề thi cuối kì 2 Hóa học 10

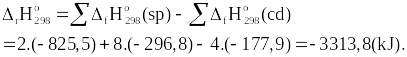
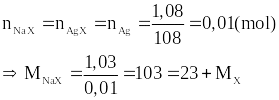
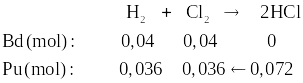
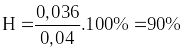
Bình luận