Đề thi cuối kì 2 Hóa học 10 KNTT: Đề tham khảo số 7
Trọn bộ Đề thi cuối kì 2 Hóa học 10 KNTT: Đề tham khảo số 7 bộ sách mới Kết nối tri thức gồm nhiều câu hỏi ôn tập hay, các dạng bài tập phong phú giúp các em củng cố ôn luyện lại kiến thức thật tốt chuẩn bị tốt cho kì thi sắp tới. Tài liệu có kèm theo đáp án và lời giải chi tiết. Hi vọng đây sẽ là tài liệu hữu ích giúp các em đạt điểm cao. Thầy cô và các em kéo xuống để tham khảo ôn luyện
PHÒNG GD & ĐT ………………. | Chữ kí GT1: ........................... |
TRƯỜNG THPT………………. | Chữ kí GT2: ........................... |
ĐỀ KIỂM TRA HỌC KÌ 2
HÓA 10 – KẾT NỐI TRI THỨC
NĂM HỌC: 2022 – 2023
Thời gian làm bài: 45 phút (Không kể thời gian phát đề)
Họ và tên: …………………………………… Lớp: ……………….. Số báo danh: …………………………….……Phòng KT:………….. | Mã phách |
"
Điểm bằng số
| Điểm bằng chữ | Chữ ký của GK1 | Chữ ký của GK2 | Mã phách |
A. PHẦN TRẮC NGHIỆM (7 điểm)
Khoanh tròn vào chữ cái đứng trước câu trả lời đúng:
Câu 1: Số oxi hoá của nitrogen trong hợp chất NH3 là
A. +1.
B. -1.
C. +3.
D. -3.
Câu 2: Trong trường hợp nào sau đây, sulfur có số oxi hoá là +4?
A. H2S.
B. S.
C. Na2SO4.
D. SO42−
Câu 3: Chất bị khử là
A. chất nhường electron.
B. chất có số oxi hoá tăng lên sau phản ứng.
C. chất nhận electron.
D. chất có số oxi hoá không thay đổi sau phản ứng.
Câu 4: Trong phản ứng hoá học: Cl2 + 2KBr → 2KCl + Br2. Chất oxi hoá là
A. Cl2.
B. KBr.
C. KCl.
D. Br2.
Câu 5: Phản ứng toả nhiệt là
A. phản ứng giải phóng năng lượng dưới dạng nhiệt.
B. phản ứng hấp thụ năng lượng dưới dạng nhiệt.
C. phản ứng làm nhiệt độ môi trường xung quanh lạnh đi.
D. phản ứng không làm thay đổi nhiệt độ môi trường xung quanh.
Câu 6: Cho hai phương trình nhiệt hoá học sau:
(1) C(s) + H2O(g) → CO(g) + H2(g) ΔrH0298=+131,25kJ.
(2) CuSO4(aq) + Zn(s) → ZnSO4(aq) + Cu(s) ΔrH0298=−231,04kJ.
Nhận xét nào sau đây là đúng?
A. Cả hai phản ứng đều toả nhiệt.
B. Cả hai phản ứng đều thu nhiệt.
C. Phản ứng (1) toả nhiệt, phản ứng (2) thu nhiệt.
D. Phản ứng (1) thu nhiệt, phản ứng (2) toả nhiệt.
Câu 7: Cho phản ứng nhiệt học sau:
4Na(s) + O2(g) ⟶ 2Na2O(s) ΔrH0298 = − 836,0 kJ.
Nhiệt tạo thành chuẩn của Na2O(s) là
A. – 836 kJ/ mol.
B. + 836 kJ/ mol.
C. – 418 kJ/ mol.
D. + 418 kJ/ mol.
Câu 8: Cho phản ứng nhiệt nhôm sau: 2Al(s) + Fe2O3(s) ![]() 2Fe(s) + Al2O3(s)
2Fe(s) + Al2O3(s)
Biến thiên enthalpy chuẩn của phản ứng nhiệt nhôm là
Biết:
Chất | Al (s) | Fe2O3 (s) | Fe (s) | Al2O3 (s) |
ΔfH0298(kJmol-1) | 0 | -825,5 | 0 | -1676,0 |
A. +850,5 kJ.
B. - 850,5 kJ.
C. -839 kJ.
D. +839 kJ.
Câu 9: Cho phản ứng sau: H2(g) + Cl2(g) → 2HCl(g). Biến thiên enthalpy chuẩn của phản ứng là (Cho: Eb (H – H) = 436 kJ/mol, Eb (Cl – Cl) = 243 kJ/mol, Eb (H – Cl) = 432 kJ/ mol)
A. +158 kJ.
B. -158 kJ.
C. +185 kJ.
D. -185 kJ.
Câu 10: Cho các phát biểu sau:
(1) Phản ứng trung hoà acid – base là phản ứng thu nhiệt.
(2) Dấu của biến thiên enthalpy cho biết phản ứng là toả nhiệt hay thu nhiệt.
(3) Biến thiên enthalpy càng âm, phản ứng toả ra càng nhiều nhiệt.
Phát biểu đúng là
A. (1), (2), (3).
B. (2), (3).
C. (2).
D. (3).
Câu 11: Tốc độ phản ứng là
A. đại lượng đặc trưng cho sự tăng nồng độ của chất phản ứng.
B. đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
C. đại lượng đặc trưng cho sự thay đổi khối lượng của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
D. đại lượng đặc trưng cho sự thay đổi nhiệt độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
Câu 12: Thông thường đối với các phản ứng có chất khí tham gia, khi tăng áp suất, tốc độ phản ứng
A. giảm.
B. không đổi.
C. tăng.
D. không xác định được.
Câu 13: Tốc độ phản ứng tính theo định luật tác dụng khối lượng là
A. tốc độ phản ứng trung bình.
B. tốc độ tức thời của phản ứng tại một thời điểm.
C. tốc độ phản ứng trung bình tại một thời điểm.
D. tốc độ phản ứng tức thời trong một khoảng thời gian.
Câu 14: Hình ảnh dưới đây minh họa ảnh hưởng của yếu tố nào tới tốc độ phản ứng:
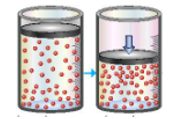
A. Diện tích bề mặt tiếp xúc.
B. Nhiệt độ.
C. Áp suất.
D. Chất xúc tác.
Câu 15: Cho phản ứng hóa học sau: 2SO2(g) + O2(g) → 2SO3(g).
Trong khoảng thời gian 420 giây, nồng độ SO2 giảm từ 0,027 M xuống 0,0194 M. Tốc độ trung bình của phản ứng tính theo nồng độ SO2 trong khoảng thời gian trên là
A. 9 × 10-2 M/s.
B. 9 × 10-3 M/s.
C. 9 × 10-5 M/s.
D. 9 × 10-6 M/s.
Câu 16: Một phản ứng có hệ số nhiệt độ Van’t Hoff bằng 3. Ở 25°C, tốc độ của phản ứng này bằng 0,2 M s-1. Tốc độ của phản ứng ở 45°C là
A. 0,6 M s-1.
B. 1,2 M s-1.
C. 1,8 M s-1.
D. 2,4 M s-1.
Câu 17: Cho phản ứng hóa học sau:
Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g)
Yếu tố nào sau đây không làm ảnh hưởng đến tốc độ phản ứng?
A. Diện tích bề mặt iron (Fe).
B. Nồng độ dung dịch hydrochloric acid.
C. Thể tích dung dịch hydrochloric acid.
D. Nhiệt độ của dung dịch hydrochloric acid.
Câu 18: Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hoá học tăng thêm 4 lần. Tốc độ phản ứng sẽ giảm đi bao nhiêu lần nhiệt khi nhiệt độ giảm từ 70oC xuống 40oC?
A. 8.
B. 16.
C. 32.
D. 64.
Câu 19: Nguyên tố halogen nào sau đây là nguyên tố phóng xạ?
A. Fluorine.
B. Chlorine.
C. Bromine.
D. Astatine.
Câu 20: Halogen nào sau đây là chất lỏng ở điều kiện thường?
A. Fluorine.
B. Chlorine.
C. Bromine.
D. Iodine.
Câu 21: Đặc điểm chung của các nguyên tố nhóm halogen là
A. chất khí ở điều kiện thường.
B. có tính oxi hóa mạnh.
C. vừa có tính oxi hóa vừa có tính khử
D. phản ứng mãnh liệt với nước.
Câu 22: Thể tích khí Cl2 (ở điều kiện chuẩn) vừa đủ để tác dụng hết với dung dịch KI thu được 2,54 gam I2 là
A. 247,9 ml.
B. 495,8 ml.
C. 371,85 ml.
D. 112 ml.
Câu 23: Phản ứng hoá học nào sau đây là không đúng?
A. H2 + Br2 ![]() 2HBr.
2HBr.
B. Cl2 + H2O ⇄ HCl + HClO.
C. 3Cl2 + 6KOH ![]() 5KCl + KClO3 + 3H2O.
5KCl + KClO3 + 3H2O.
D. I2 + H2O ⇄ HI + HIO.
Câu 24: Hóa chất dùng để phân biệt các dung dịch: NaF, NaCl, NaBr, NaI là
A. dung dịch HCl.
B. quỳ tím.
C. dung dịch AgNO3.
D. dung dịch BaCl2.
Câu 25: Phản ứng giữa chất nào sau đây với dung dịch H2SO4 đặc, nóng không phải là phản ứng oxi hóa – khử?
A. KBr.
B. KI.
C. NaCl.
D. NaBr.
Câu 26: Hòa tan 1,3 gam Zinc (Zn) trong dung dịch HCl dư. Sau phản ứng thu được thể tích khí H2 ở điều kiện chuẩn là
A. 0,2479 lít.
B. 0,4958 lít.
C. 0,5678 lít.
D. 1,487 lít.
Câu 27: Cho dung dịch A chứa 1,17g NaCl tác dụng với dung dịch B chứa 5,1g AgNO3 thu được m gam kết tủa. Giá trị của m là
A. 28,70 gam.
B. 43,05 gam.
C. 2,87 gam.
D. 4,31 gam.
Câu 28: Liên kết trong hợp chất hydrogen halide là
A. liên kết cộng hóa trị có cực.
B. liên kết cho – nhận.
C. liên kết ion.
D. liên kết cộng hóa trị không cực.
PHẦN TỰ LUẬN (3 điểm)
Câu 1 (2 điểm): Trong phòng thí nghiệm, khí chlorine được điều chế theo sơ đồ sau:
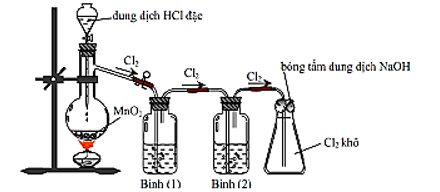
a) Viết phương trình hoá học của phản ứng xảy ra trong bình cầu, chỉ rõ chất khử, chất oxi hoá, quá trình oxi hoá, quá trình khử.
b) Biết bình (1) đựng dung dịch NaCl bão hoà; bình (2) đựng dung dịch H2SO4 đặc. Giải thích vai trò của bình (1); bình (2) và nút bông tẩm dung dịch NaOH ở bình tam giác.
c) Giả sử lượng chlorine sinh ra phản ứng vừa đủ với 200 mL dung dịch chứa NaI 0,1M. Tính khối lượng MnO2 đã phản ứng để thu được lượng chlorine trên.
Câu 2 (1điểm): Cho 1,03 gam muối sodium halide (A) tác dụng với dung dịch AgNO3 dư thì thu được một kết tủa. Kết tủa sau khi phân huỷ hoàn toàn cho 1,08 gam silver (bạc). Xác định tên muối (A).
BÀI LÀM
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
|
%
TRƯỜNG THPT ........
HƯỚNG DẪN CHẤM KIỂM TRA HỌC KÌ 2 (2022 – 2023)
MÔN: HÓA HỌC 10– KẾT NỐI TRI THỨC
A. PHẦN TRẮC NGHIỆM: (7,0 điểm)
Mỗi câu trả lời đúng được 0,25 điểm.
1. B | 2. D | 3. A | 4. C | 5. D | 6. B | 7. C |
8. D | 9.A | 10. A | 11. C | 12.C | 13. C | 14. B |
15. D | 16.C | 17. C | 18. B | 19. C | 20. C | 21. C |
22. D | 23. D | 24. A | 25. A | 26. D | 27.B | 28. B |
B. PHẦN TỰ LUẬN: (3,0 điểm)
Câu | Nội dung đáp án | Biểu điểm |
Câu 1 (1 điểm) |
Các halogen có tính oxi hóa mạnh hơn sẽ phản ứng với muối halide có tính oxi hóa yếu hơn Cl2 + 2NaBr → 2NaCl + Br2 → Cl2 có tính oxi hóa mạnh hơn sẽ phản ứng với NaBr tạo thành halogen có tính oxi hóa yếu hơn là Br2. → Chlorine có tính oxi hóa mạnh hơn bromine |
1đ
|
Câu 2 (1 điểm) |
10NaI + 2KMnO4 + 8H2SO4→ 2MnSO4 + 5I2 + 5Na2SO4 + K2SO4 + 8H2O Chất khử NaI Chất oxi hóa KMnO4 Quá trình khử
Quá trình oxi hóa 2I-1→ I20 + 2e
10NaI + 2KMnO4 + 8H2SO4 → 2MnSO4 + 5I2 + 5Na2SO4 + K2SO4 + 8H2O 0,02 → 0,05 mol Vậy
|
1 đ
|
Câu 3 | Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng. Sử dụng AgNO3 làm thuốc thử. - Nếu xuất hiện kết tủa vàng → NaI NaI + AgNO3 → AgI ↓ + NaNO3 - Nếu xuất hiện kết tủa trắng → HCl và NaCl ( nhóm 1) HCl + AgNO3 → AgCl ↓+ HNO3 NaCl + AgNO3 → AgCl ↓+ NaNO3 Phân biệt nhóm I dùng Na2CO3 - Nếu xuất hiện sủi bọt khí → HCl 2HCl + Na2CO3 → 2NaCl + CO2 + H2O - Không có hiện tượng → NaCl |
1đ |
TRƯỜNG THPT .........
MA TRẬN ĐỀ KIỂM TRA HỌC KÌ 2 (2022 – 2023)
MÔN: HÓA HỌC 10 – KẾT NỐI TRI THỨC
CHỦ ĐỀ | MỨC ĐỘ | Tổng số câu |
Điểm số | ||||||||
Nhận biết | Thông hiểu | Vận dụng | VD cao | ||||||||
TL | TN | TL | TN | TL | TN | TL | TN | TL | TN | ||
PHẢN ỨNG OXI HÓA KHỬ |
| 2 |
| 2 |
|
|
|
|
| 4 | 1 |
NĂNG LƯỢNG HÓA HỌC |
| 4 |
| 2 |
|
|
|
|
| 6 | 1,5 |
TỐC ĐỘ PHẢN ỨNG HÓA HỌC |
| 4
|
| 4 |
|
|
|
|
|
8 |
2 |
NGUYÊN TỐ NHÓM VIIA |
| 6 |
| 4 | 1 |
| 1 |
| 2 | 10 | 5,5 |
Tổng số câu TN/TL | 0 | 16 | 0 | 12 | 1 | 0 | 1 | 0 | 3 | 28 | 10,0 |
Điểm số |
| 4 | 0 | 3 | 2 | 0 | 1 | 0 | 3 | 7 | 10 |
Tổng số điểm | 4 điểm 40% | 3 điểm 30% | 2 điểm 20% | 1 điểm 10% | 10 điểm 10 % | 10 điểm | |||||
Thêm kiến thức môn học
Đề thi Hóa học 10 Kết nối tri thức, trọn bộ đề thi Hóa học 10 Kết nối tri thức, Đề thi cuối kì 2 Hóa học 10

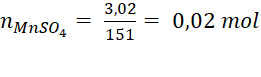
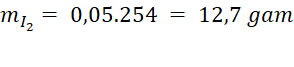
Bình luận