Đề thi cuối kì 2 Hóa học 10 KNTT: Đề tham khảo số 3
Trọn bộ Đề thi cuối kì 2 Hóa học 10 KNTT: Đề tham khảo số 3 bộ sách mới Kết nối tri thức gồm nhiều câu hỏi ôn tập hay, các dạng bài tập phong phú giúp các em củng cố ôn luyện lại kiến thức thật tốt chuẩn bị tốt cho kì thi sắp tới. Tài liệu có kèm theo đáp án và lời giải chi tiết. Hi vọng đây sẽ là tài liệu hữu ích giúp các em đạt điểm cao. Thầy cô và các em kéo xuống để tham khảo ôn luyện
MA TRẬN ĐỀ THI HỌC KÌ 2
MÔN: HÓA HỌC 10 – KẾT NỐI TRI THỨC
Số TT | Nội dung kiến thức | Đơn vị kiến thức | Mức độ nhận thức | Tổng số câu | Tổng % điểm | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Nhận biết | Thông hiểu | Vận dụng | Vận dụng cao | ||||||||||
TN | TL | TN | TL | TN | TL | TN | TL | TN | TL | ||||
1 | Phản ứng oxi hóa khử | Số oxi hóa | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 2 | 1 | 20% |
Phản ứng oxi hóa – khử | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 2 | ||||
2 | Năng lượng hóa học | Phản ứng hóa học và enthalpy | 2 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 15% |
Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học | 2 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 3 | ||||
3 | Tốc độ phản ứng hóa học | Tốc độ phản ứng hóa học | 4 | 0 | 4 | 0 | 0 | 0 | 0 | 0 | 8 | 0 | 20% |
4 | Nguyên tố nhóm VIIA | Nguyên tố và đơn chất halogen | 3 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 5 | 0 | 45% |
Hydrogen halide và hydrohalic acid | 3 | 0 | 2 | 0 | 0 | 0 | 0 | 1 | 5 | 1 | |||
Tổng số câu | 16 | 0 | 12 | 0 | 0 | 1 | 0 | 1 | 28 | 2 |
| ||
Tỉ lệ % | 40% | 30% | 15% | 15% |
|
|
| ||||||
Tỉ lệ chung | 70% | 30% |
|
|
| ||||||||
BẢNG ĐẶC TẢ KĨ THUẬT ĐỀ THI HỌC KÌ 2
MÔN: HÓA HỌC 10 – KẾT NỐI TRI THỨC
TT | Nội dung kiến thức | Đơn vị kiến thức | Mức độ kiến thức, kĩ năng cần kiểm tra, đánh giá | Số câu hỏi theo các mức độ nhận thức | Tổng | |||
NB | TH | VD | VCD | |||||
1 | Phản ứng oxi hóa – khử | Số oxi hóa | Nhận biết: Số oxi hóa của nguyên tố trong đơn chất, hợp chất Thông hiểu: Xác định được số oxi hóa của nguyên tố trong một số hợp chất cụ thể |
1 |
1 |
|
|
2 |
Phản ứng oxi hóa – khử | Nhận biết: Khái niệm chất oxi hóa, chất khử, sự oxi hóa, sự khử Thông hiểu: Xác định được chất oxi hóa, chất khử, quá trình oxi hóa, quá trình khử trong phản ứng oxi hóa khử Vận dụng: Lập được phương trình hóa học của một số phản ứng oxi hóa – khử |
1 |
1 |
1 |
|
3 | ||
2 | Năng lượng hóa học | Phản ứng hóa học và enthalpy | Nhận biết: - Dự đoán các phản ứng hóa học là phản ứng tỏa nhiệt hay thu nhiệt - Trình bày được khái niệm phản ứng tỏa nhiệt, thu nhiệt, điều kiện chuẩn Thông hiểu: Đếm số phát biểu đúng sai liên quan đến biến thiên enthalpy |
2 |
1 |
|
|
3 |
Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học | Nhận biết: - Nêu được ý nghĩa của dấu và giá trị - Dựa vào nhiệt phản ứng xác định phản ứng là tỏa nhiệt hay thu nhiệt. Thông hiểu: Đếm số phát biểu đúng sai liên quan đến ý nghĩa biến thiên enthalpy |
2 |
1 |
|
|
3 | ||
3 | Tốc độ phản ứng hóa học | Tốc độ phản ứng hóa học | Nhận biết: - Trình bày được khái niệm tốc độ phản ứng hóa học và cách tính tốc độ trung bình của phản ứng. - Viết được biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng và nồng độ. - Nêu được ý nghĩa của hệ số nhiệt đới Van’t Hoff ( Thông hiểu: - Giải thích được các yếu tố ảnh hưởng tới tốc độ phản ứng như: nồng độ, nhiệt độ, áp suất, diện tích bề mặt, chất xúc tác. - Tính được tốc độ trung bình của một phản ứng hóa học - Vận dụng được kiến thức tốc độ phản ứng hóa học vào việc giải thích một số vấn đề trong cuộc sống và sản xuất. |
4 |
4 |
|
|
8 |
4 | Nguyên tố nhóm VIIA | Nguyên tố và đơn chất halogen | Nhận biết: - Phát biểu được trạng thái tự nhiên của các nguyên tố halogen - Chỉ ra được trạng thái, màu sắc, nhiệt độ nóng chảy, nhiệt độ sôi của các đơn chất halogen. - Chỉ ra được hiện tượng của các thí nghiệm so sánh tính oxi hóa của các halogen Thông hiểu - Viết sản phẩm phản ứng thể hiện tính chất của đơn chất halogen - Tính thể tích khí chlorine (ở đktc) tạo thành trong phản ứng đơn giản - So sánh được tính oxi hóa giữa các halogen Vận dụng: Bài tập liên quan đến tính chất hóa học của các đơn chất halogen |
3 |
2 |
1
|
|
6 |
Hydrogen halide và hydrohalic acid | Nhận biết: - Trình bày được xu hướng biến đổi tính acid của dãy hydrohalic acid. - Chỉ ra được hiện tượng của phản ứng khi cho dung dịch AgNO3 tác dụng với ion X- - Nêu được ứng dụng của một số hydrogen halide Thông hiểu: - Tính được khối lượng kim loại trong phản ứng đơn giản có HCl tham gia - Viết được PTHH thể hiện tính chất hóa học của các acid HX. Vận dụng cao: Vận dụng giải bài tập liên quan đến hydrohalic acid, ion halide X |
3 |
2 |
|
1 |
6 | ||
Tổng |
| 16 | 12 | 2 | 1 | 31 | ||
Tỉ lệ % từng mức độ nhận thức |
| 40% | 30% | 20% | 10% | 100% | ||
Tỉ lệ chung |
| 70% | 30% |
| ||||
ĐỀ KIỂM TRA HỌC KÌ 2
MÔN: HÓA HỌC 10 – KẾT NỐI TRI THỨC
Phần I: Trắc nghiệm (7 điểm)
Câu 1. Quy tắc xác định số oxi hóa nào sau đây là không đúng?
A. Trong hợp chất, tổng số oxi hóa của các nguyên tử trong phân tử bằng 0
B. Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích ion
C. Trong hợp chất, số oxi hóa của kim loại kiềm thổ là +1
D. Thông thường số oxi hóa của hydrogen trong hợp chất là +1
Câu 2. Số oxi hóa của phosphorus trong hợp chất P2O5 là
A. –5
B. +5
C. -3
D. +3
Câu 3. Trong các phản ứng hóa học sau, phản ứng oxi hóa – khử là
A. HCl + KOH ![]() KCl + H2O
KCl + H2O
B. H2SO4 + Na2CO3 ![]() Na2SO4 + CO2 + H2O
Na2SO4 + CO2 + H2O
C. Fe3O4 + 8HCl ![]() FeCl2 + 2FeCl3 + 4H2O
FeCl2 + 2FeCl3 + 4H2O
D. FeO + 4HNO3 ![]() Fe(NO3)3 + NO2 + 2H2O
Fe(NO3)3 + NO2 + 2H2O
Câu 4. Cho phản ứng khử Fe2O3 bằng CO để sản xuất gang và thép như sau:
Fe2O3 + 3CO ![]() 2Fe + 3CO2
2Fe + 3CO2
Trong phản ứng này, chất khử là
A. Fe2O3
B. CO
C. Fe
D. CO2
Câu 5. Cho các phản ứng sau:
(1) Phản ứng nung vôi: CaCO3(s) ![]() CaO(s) + CO2(g)
CaO(s) + CO2(g)
(2) Phản ứng trung hòa: KOH(aq) + HCl(aq) ![]() KCl(aq) + H2O(l)
KCl(aq) + H2O(l)
Nhận xét đúng là
A. cả hai phản ứng đều tỏa nhiệt
B. cả hai phản ứng đều thu nhiệt
C. phản ứng (1) tỏa nhiệt, phản ứng (2) thu nhiệt
D. phản ứng (1) thu nhiệt, phản ứng (2) tỏa nhiệt
Câu 6. Cho phương trình nhiệt hóa học sau:
2H2(g) + O2(g) ![]() 2H2O
2H2O ![]()
Nhiệt tạo thành của H2O (l) ở điều kiện chuẩn là
A. – 571,6 kJ/mol
B. 571,6 kJ/mol
C. – 285,8 kJ/mol
D. 285,8 kJ/mol
Câu 7. Cho phương trình nhiệt hóa học sau:
N2(g) + O2(g) ![]() 2NO(g)
2NO(g) ![]()
Kết luận nào sau đây là đúng?
A. Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp
B. Phản ứng tỏa nhiệt
C. Phản ứng xảy ra thuận lợi ở điều kiện thường
D. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường
Câu 8. Cho phương trình nhiệt hóa học đốt cháy acetylene (C2H2):
2C2H2(g) + 5O2(g) ![]() 4CO2(g) + 2H2O(l)
4CO2(g) + 2H2O(l) ![]()
Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) lần lượt là -393,5 kJ/mol và -285,8 kJ/mol. Nhiệt tạo thành chuẩn của acetylene (C2H2) là
A. +259 kJ/mol
B. -259 kJ/mol
C. +227,4 kJ/mol
D. -227,4 kJ/mol
Câu 9. Phản ứng tổng hợp ammonia:
N2(g) + 3H2(g) ![]() 2NH3
2NH3 ![]()
Biết năng lượng liên kết (kJ/mol) của N ![]() N và H – H lần lượt là 946 và 436. Năng lượng liên kết của N – H trong ammonia là
N và H – H lần lượt là 946 và 436. Năng lượng liên kết của N – H trong ammonia là
A. 391 kJ/mol
B. 361 kJ/mol
C. 245 kJ/mol
D. 490 kJ/mol
Câu 10. Cho các phát biểu sau:
(a) Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt
(b) Biến thiên enthalpy càng lớn thì nhiệt lượng tỏa ra của phản ứng càng nhiều
(c) Nhiệt tạo thành chuẩn là nhiệt tạo thành ở điều kiện chuẩn
(d) Nhiệt tạo thành chuẩn của các đơn chất ở dạng bền vững nhất bằng không
Số phát biểu đúng là
A. 1
B. 2
C. 3
D. 4
Câu 11. Yếu tố nào sau đây không làm ảnh hưởng đến tốc độ phản ứng?
A. Nồng độ
B. Nhiệt độ
C. Áp suất
D. Khối lượng chất rắn
Câu 12. Thực hiện 2 thí nghiệm theo hình vẽ sau
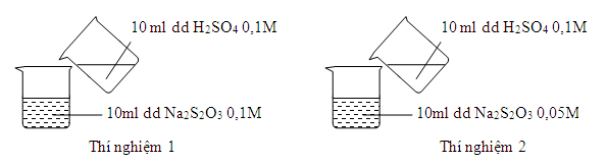
Ở thí nghiệm nào xuất hiện kết tủa trước?
A. Thí nghiệm 1 có kết tủa xuất hiện trước
B. Thí nghiệm 2 có kết tủa xuất hiện trước
C. Không xác định được
D. Không có kết tủa xuất hiện
Câu 13. Cho phản ứng đơn giản như sau: 3H2(g) + N2(g) ![]() 2NH3(g). Tốc độ phản ứng thay đổi như thế nào nếu nồng độ H2 không đổi và nồng độ N2 tăng 2 lần?
2NH3(g). Tốc độ phản ứng thay đổi như thế nào nếu nồng độ H2 không đổi và nồng độ N2 tăng 2 lần?
A. Tăng 2 lần
B. Tăng 4 lần
C. Tăng 8 lần
D. Tăng 6 lần
Câu 14. Cho phản ứng hóa học sau: Mg(s) + 2HCl(aq) ![]() MgCl2(aq) + H2(g)
MgCl2(aq) + H2(g)
Sau 40 giây, nồng độ của dung dịch HCl giảm từ 0,6 M về còn 0,4 M. Tốc độ trung bình của phản ứng theo HCl trong 40 giây là
A. 5 ![]() 10-3 (M/s)
10-3 (M/s)
B. 5 ![]() 103 (M/s)
103 (M/s)
C. 2,5 ![]() 10-3 (M/s)
10-3 (M/s)
D. 2,5 ![]() 103 (M/s)
103 (M/s)
Câu 15. Yếu tố nào dưới đây đã được sử dụng để làm tăng tốc độ phản ứng khi rắc men vào tinh bột đã được nấu chín (cơm, ngô, khoai, sắn) để ủ rượu?
A. Nhiệt độ
B. Chất xúc tác
C. Nồng độ
D. Áp suất
Câu 16. Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hóa học tăng thêm 2 lần. Để tốc độ phản ứng đó (đang tiến hành ở 20oC) tăng lên 32 lần thì cần thực hiện phản ứng ở nhiệt độ bao nhiêu lần?
A. 40 oC
B. 50 oC
C. 60 oC
D. 70 oC
Câu 17. Chất xúc tác là chất
A. làm tăng tốc độ phản ứng và bị mất đi sau phản ứng
B. làm giảm tốc độ phản ứng và không bị mất đi sau phản ứng
C. làm giảm tốc độ phản ứng và bị mất đi sau phản ứng
D. làm tăng tốc độ phản ứng và không bị mất đi sau phản ứng
Câu 18. Tốc độ của một phản ứng hóa học lớn nhất khoảng thời điểm nào?
A. Bắt đầu phản ứng
B. Khi phản ứng được một nửa lượng chất so với ban đầu
C. Gần cuối phản ứng
D. Không xác định được
Câu 19. Nguyên tố nào sau đây không thuộc nhóm halogen?
A. Fluorine
B. Chlorine
C. Chromium
D. Bromine
Câu 20. Cấu hình electron lớp ngoài cùng của các halogen có dạng
A. ns2np1
B. ns2np3
C. ns2np5
D. ns2np7
Câu 21. Phương trình hóa học nào sau đây không đúng?
A. Fe + Cl2 ![]() FeCl2
FeCl2
B. H2 + F2 ![]() 2HF
2HF
C. Cl2 + H2O ![]() HCl + HclO
HCl + HclO
D. Br2 + 2NaI ![]() 2NaBr + I2
2NaBr + I2
Câu 22. Cho 1,2395 lít halogen X2 (ở điều kiện chuẩn) tác dụng vừa đủ với kim loại đồng (copper) thu được 11,2 gam muối CuX2. Nguyên tố halogen là
A. fluorine
B. chlorine
C. bromine
D. iodine
Câu 23. Trong các đơn chất: F2, Cl2, Br2, I2, chất có nhiệt độ nóng chảy và nhiệt độ sôi cao nhất là
A. F2
B. Cl2
C. Br2
D. I2
Câu 24. Phản ứng giữa cặp chất nào sau đây không xảy ra?
A. KI và Br2
B. AgNO3 và HCl
C. AgNO3 và NaF
D. KI và Cl2
Câu 25. Hydrohalic acid nào sau đây không được bảo quản trong lọ thủy tinh?
A. HCl
B. HF
C. HBr
D. HI
Câu 26. Hai chất nào sau đây được cho vào muối ăn để bổ sung nguyên tố iodine, phòng ngừa bệnh bướu cổ ở người?
A. I2, HI
B. HI, HIO3
C. KI, KIO3
D. I2, AlI3
Câu 27. Để trung hòa 200 ml dung dịch NaOH 1M thì thể tích dung dịch HCl 0,5M cần dùng là
A. 0,5 lít
B. 0,4 lít
C. 0,3 lít
D. 0,6 lít
Câu 28. Chọn phát biểu đúng?
A. Các hydrogen halide không tan trong nước
B. Ion F- và Cl- bị oxi hóa bởi dung dịch H2SO4 đặc
C. Các hydrohalic acid làm quỳ tím hóa đỏ
D. Tính acid của các hydrohalic acid giảm dần từ HF đến HI
Phần II. Tự luận (3 điểm)
Câu 1 (2 điểm): Trong phòng thí nghiệm, chlorine có thể được điều chế bằng cách cho KMnO4 rắn tác dụng với HCl đặc.
a) Viết phương trình hóa học xảy ra và chỉ rõ chất khử, chất oxi hóa, quá trình oxi hóa, quá trình khử.
b) Giả sử lượng chlorine sinh ra phản ứng vừa đủ với 200 ml dung dịch chứa NaI 0,1M. Tính khối lượng KMnO4 đã phản ứng để thu được lượng chlorine trên
Câu 2 (1 điểm): X và Y là hai nguyên tố halogen thuộc hai chu kì liên tiếp trong bảng hệ thống tuần hoàn. Hỗn hợp A có chứa 2 muối của X và Y với sodium.
a) Đã kết tủa hoàn toàn 2,2 gam hỗn hợp A, phải dùng 150 ml dung dịch AgNO3 0,2M. Tính khối lượng kết tủa thu được.
b) Xác định hai nguyên tố X, Y.
ĐÁP ÁN ĐỀ THI HỌC KÌ 2
MÔN: HÓA HỌC 10 – KẾT NỐI TRI THỨC
Phần I: Trắc nghiệm
1 - C | 2 - B | 3 - D | 4 - B | 5 - D | 6 - A | 7 - D | 8 – D | 9 - A | 10 - D |
11 - D | 12 - A | 13 - C | 14 - C | 15 - B | 16 - D | 17 - B | 18 - D | 19 - C | 20 - C |
21 - A | 22 - C | 23 - D | 24 - C | 25 - B | 26 - C | 27 - B | 28 - C | ||
Phần II; Tự luận
Câu 1:
a) 8HCl + 2KMnO4 ![]() 3Cl2 + 2MnO2 + 2KCl+ 4H2O
3Cl2 + 2MnO2 + 2KCl+ 4H2O
Chất khử: HCl
Chất oxi hóa: KMnO4
Quá trình khử: ![]()
Quá trình oxi hóa: ![]()
b) Cl2 + 2NaI ![]() I2 + 2NaCl
I2 + 2NaCl
0,01 0,02
8HCl + 2KMnO4 ![]() 3Cl2 + 2MnO2 + 2KCl+ 4H2O
3Cl2 + 2MnO2 + 2KCl+ 4H2O
![]() 0,01
0,01
![]()
Câu 2.
NaX + AgNO3 ![]() NaNO3 + AgX
NaNO3 + AgX
a mol a a a
NaY + AgNO3 ![]() NaNO3 + AgY
NaNO3 + AgY
b mol b b b
![]()
![]()
Áp dụng định luật bảo toàn khối lượng ta có:
2,2 + 5,1 = 2,55 + mkết tủa ![]() mkết tủa = 4,75 (gam)
mkết tủa = 4,75 (gam)
(108 + X)a +(108 + Y)b = 4,75; a + b = 0,03 (mol)
Xa + Yb + 15,1, cho X > Y; Xa + Xb > Xa + Yb > Ya + Yb
X > ![]() > Y
> Y ![]() X > 50,3 > Y
X > 50,3 > Y
X và Y là các halogen liên tiếp, vậy đó là Br (80) và Cl (35,5)
Thêm kiến thức môn học
Đề thi Hóa học 10 Kết nối tri thức, trọn bộ đề thi Hóa học 10 Kết nối tri thức, Đề thi cuối kì 2 Hóa học 10

Bình luận