Slide bài giảng KHTN 7 kết nối bài 4: sơ lược về bảng tuần hoàn các nguyên tố hóa học (7 tiết)
Slide điện tử bài 4: sơ lược về bảng tuần hoàn các nguyên tố hóa học (7 tiết). Kiến thức bài học được hình ảnh hóa, sinh động hóa. Trình bày với các hiệu ứng hiện đại, hấp dẫn. Giúp học sinh hứng thú học bài. Học nhanh, nhớ lâu. Có tài liệu này, hiệu quả học tập của học môn Khoa học tự nhiên 7 kết nối tri thức sẽ khác biệt
Bạn chưa đủ điều kiện để xem được slide bài này. => Xem slide bài mẫu
Tóm lược nội dung
BÀI 4. SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
MỞ ĐẦU
Câu hỏi: Ngày nay, người ta đã xác định được hàng chục triệu chất hóa học với các tính chất khác nhau được tạo thành từ hơn một trăm nguyên tố hóa học. Liệu có nguyên tắc nào sắp xếp các nguyên tố để dễ nhận ra tính chất của chúng không?
Trả lời rút gọn:
Nguyên tắc sắp xếp các nguyên tố để dễ dàng nhận ra tính chất của chúng: Xếp theo chiều tăng dần của điện tích hạt nhân, các nguyên tố trong cùng một hàng có cùng số lớp electron trong nguyên tử, các nguyên tố trong cùng cột có tính chất gần giống nhau.
I. NGUYÊN TẮC SẮP XẾP CÁC NGUYÊN TỐ HÓA HỌC TRONG BẢNG TUẦN HOÀN
Câu 1: Sự thay đổi số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong một hàng khi đi từ trái sang phải.
Trả lời rút gọn:
Số electron tăng dần.
Câu 2: Số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong cùng một cột
Trả lời rút gọn:
Số electron bằng nhau.
Câu 1: Dựa vào đặc điểm nào về cấu tạo nguyên tử để sắp xếp các nguyên tố vào hàng, vào cột trong bảng tuần hoàn?
Trả lời rút gọn:
Dựa vào các đặc điểm: điện tích của hạt nhân, số lớp electron trong nguyên tử, số electron ở lớp ngoài cùng của nguyên tử.
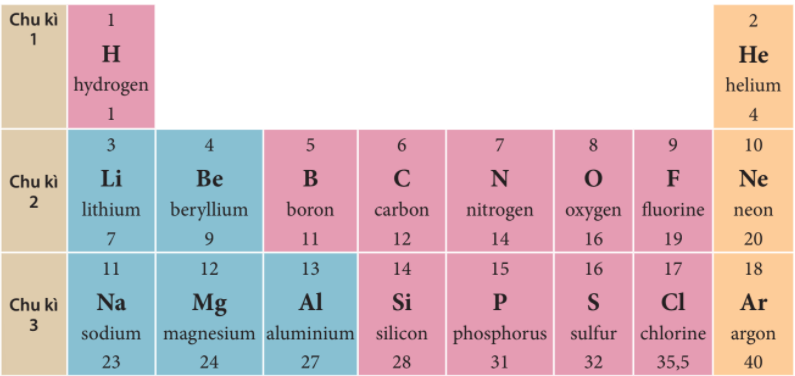
Câu 2: Sử dụng bảng tuần hoàn, hãy cho biết các nguyên tố nào trong số các nguyên tố Li, Na, C, O có cùng số lớp electron trong nguyên tử.
Trả lời rút gọn:
Li, C, O có cùng số lớp electron trong nguyên tử.
II. CẤU TẠO BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
1. Ô nguyên tố
Câu 1: Quan sát hình 4.2, cho biết số proton, electron trong nguyên tử oxygen
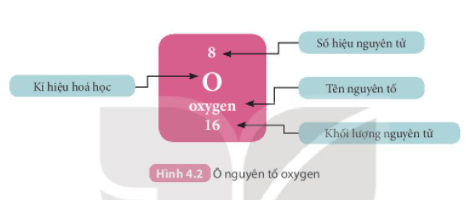
Trả lời rút gọn:
Trong nguyên tử oxygen có 8 electron và 8 proton.
Câu 2: Sử dụng bảng tuần hoàn và cho biết kí hiệu hóa học, tên nguyên tố, số hiệu nguyên tử, khối lượng nguyên tử và số electron trong nguyên tử của các nguyên tố ở ô số 6, 11
Trả lời rút gọn:
Nguyên tố ô số 6 là Carbon (C), số hiệu nguyên tử là 6, khối lượng nguyên tử là 12 và số electron trong nguyên tử là 8
Nguyên tố ô số 11 là sodium (Na), số hiệu nguyên tử là 11, khối lượng nguyên tử là 23 và số electron trong nguyên tử là 11
2. Chu kì
Quan sát các mô hình đã chuẩn bị, thảo luận và thực hiện các yêu cầu sau:
Câu 1: Hãy cho biết số lớp electron của nguyên tử các nguyên tố trên
Trả lời rút gọn:
H, He có 1 lớp electron
Li, Be, C, N có 2 lớp electron
Câu 2: So sánh số lớp electron của nguyên tử các nguyên tố trên với số thứ tự chu kì của các nguyên tố đó.
Trả lời rút gọn:
Số lớp electron của nguyên tử các nguyên tố trên bằng với số thứ tự chu kì của các nguyên tố đó.
Câu 1: Quan sát hình 4.3 và cho biết tên, kí hiệu hóa học và điện tích hạt nhân của nguyên tử các nguyên tố xung quanh nguyên tố carbon.
Trả lời rút gọn:
Nguyên tố xung quanh nguyên tố carbon | Kí hiệu hóa học | Điện tích hạt nhân nguyên tử |
| Boron | B | 5 |
| Nitrogen | N | 7 |
| Aluminium | Al | 13 |
| Silicon | Si | 14 |
| Phosphorus | P | 15 |
Câu 2: Hãy cho biết số lớp electron của nguyên tử các nguyên tố thuộc chu kì 3. Giải thích.
Trả lời rút gọn:
Nguyên tử các nguyên tố thuộc chu kì 3 có 3 lớp electron.
3. Nhóm
Câu 1: Nguyên tử các nguyên tố nào có cũng số electron ở lớp ngoài cùng
Trả lời rút gọn:
Li, Na, F, Cl
Câu 2: Hãy so sánh số electron lớp ngoài cùng của nguyên tử các nguyên tố với số thứ tự nhóm của các nguyên tố
Trả lời rút gọn:
Số electron lớp ngoài cùng của nguyên tử các nguyên tố chính là số thứ tự nhóm của các nguyên tố .
Câu 1: Số electron lớp ngoài cùng của nguyên tử hai số Al và S. Giải thích
Trả lời rút gọn:
Nguyên tử Al có 3 electron lớp ngoài cùng vì ở nhóm IIIA, nguyên tử S có 6 electron lớp ngoài cùng vì ở nhóm VIA.
Câu 2: Hãy kể tên nguyên tố thuộc chu kì nhỏ và cùng nhóm với nguyên tố berrylium
Trả lời rút gọn:
Mg.
III. VỊ TRÍ CÁC NHÓM NGUYÊN TỐ KIM LOẠI, PHI KIM VÀ KHÍ HIẾM TRONG BẢNG TUẦN HOÀN
1. Các nguyên tố kim loại
Câu 1: Sử dụng bảng tuần hoàn, hãy xác định vị trí ( số thứ tự, chu kì nhóm) của các nguyên tố Al, Ca, Na
Trả lời rút gọn:
Al: Số thứ tự 13, thuộc chu kì IIIA
Ca: Số thứ tự 20, thuộc chu kì IIA
Na: Số thứ tự 11, thuộc chu kì IA
Câu 2: Tính chất nào của nhốm, sắt, đồng đã được dùng trong các ứng dụng ở trong hình 4.6

Trả lời rút gọn:
Tính chất của nhôm, sắt, đồng: làm màng bọc thực phẩm, làm lõi dây điện, dùng trong công trình dây dựng, dùng làm trang sức
2. Các nguyên tố phi kim
Câu hỏi: Sử dụng bảng tuần hoàn, hãy xác định vị trí ( số thứ tự, chu kì, nhóm) của các nguyên tố có tên trong hình 4.7

Trả lời rút gọn:
O: số thứ tự 8, thuộc nhóm VIA
Cl: số thứ tự 17 thuộc nhóm VIIA
S: số thứ tự 16 thuộc nhóm VIA
Br: số thứ tự 35 thuộc nhóm VIIA
3. Các nguyên tố khí hiếm
Câu 1: Sử dụng bảng tuần hoàn, hãy xác định vị trí, số thứ tự, chu kì, nhóm của khí hiếm Neon
Trả lời rút gọn:
Khí hiếm Neon có: Số thứ tự 10, đứng sau F, nằm ở nhóm VIIIA, chu kì 2.
Câu 2: Bảng tuần hoàn các nguyên tố hóa học gồm các nguyên tố:
A. Kim loại, phi kim
B. Phi kim và khí hiếm
C. Kim loại và khí hiếm
D, Kim loại, phi kim, khí hiếm
Trả lời rút gọn:
D.
Câu 3: Cho các nguyên tố sau: P. Ba. Rb, Cu, Fe, Ne, S
a. Sử dụng bảng tuần hoàn, hãy cho biết trong các nguyên tố trên, nguyên tố nào là kim loại, nguyên tố nào là phi kim
b. Nêu ứng dụng trong đời sống của một nguyên tố trong số các nguyên tố trên.
Trả lời rút gọn:
a.
Ba, Rb, Cu, Fe là kim loại
P, Si là phi kim
Ne là khí hiếm
b. Ứng dụng của Fe: luyện thép, gang.
