Slide bài giảng hóa học 10 cánh diều bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm
Slide điện tử bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm. Trình bày với các hiệu ứng hiện đại, hấp dẫn. Giúp học sinh hứng thú học bài. Học nhanh, nhớ lâu. Có tài liệu này, hiệu quả học tập của môn Hóa học 10 Cánh diều sẽ khác biệt
Bạn chưa đủ điều kiện để xem được slide bài này. => Xem slide bài mẫu
Tóm lược nội dung
BÀI 7. XU HƯỚNG BIẾN ĐỔI MỘT SỐ TÍNH CHẤT CỦA ĐƠN CHẤT, BIẾN ĐỔI THÀNH PHẦN VÀ TÍNH CHẤT CỦA HỢP CHẤT TRONG MỘT CHU KÌ VÀ TRONG MỘT NHÓM
KHỞI ĐỘNG
- GV chiếu hình ảnh về công thức của định luật Culomb (thể hiện mối liên hệ giữa lực hút, điện tích hạt nhân,, khoảng cách giữa hạt nhân và electron), yêu cầu HS thảo luận theo nhóm và trả lời các câu hỏi sau:
(1) Điện tích hạt nhân càng lớn thì lực hút electron càng mạnh hay càng yếu? Vì sao?
(2) Khoảng cách giữa electron và hạt nhân càng lớn thì electron bị hút càng mạnh hay càng yếu? Vì sao?
NỘI DUNG BÀI HỌC GỒM
- XU HƯỚNG BIẾN ĐỔI BÁN KÍNH NGUYÊN TỬ.
- Trong một chu kì.
- Trong một nhóm.
XU HƯỚNG BIẾN ĐỔI ĐỘ ÂM ĐIỆN, TÍNH KIM LOẠI VÀ TÍNH PHI KIM.
- Độ âm điện.
- Tính kim loại, tính phi kim.
HÌNH THÀNH KIẾN THỨC
I. XU HƯỚNG BIẾN ĐỔI BÁN KÍNH NGUYÊN TỬ
Bán kính nguyên tử là khoảng cách từ hạt nhân đến electron ở lớp vỏ ngoài cùng.
1. Trong một chu kì
GV yêu cầu học sinh trao đổi thực hiện: Trong một chu kì bán kính nguyên tử biến đổi theo xu hướng nào? Giải thích.
Nội dung ghi nhớ:
Trong một chu kì, từ trái sang phải theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử có xu hướng giảm vì điện tích hạt nhân tăng dần nên hạt nhân sẽ hút electron mạnh hơn.
2. Trong một nhóm
GV yêu cầu học sinh trao đổi thực hiện: Trong một nhóm bán kính nguyên tử biến đổi theo xu hướng nào?
Nội dung ghi nhớ:
Trong một nhóm A, từ trên xuống dưới theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử có xu hướng tăng dần vì số lớp electron tăng dần.
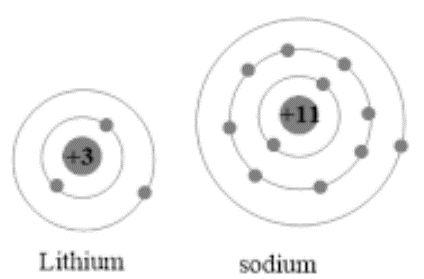
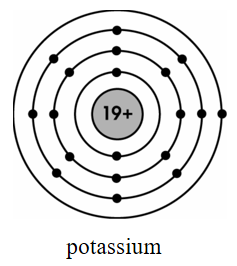
Hình vẽ mô hình nguyên tử Li, Na và K.
Nguyên tử Li, Na và K có điện tích nguyên tử tăng nhưng bán kính không giảm vì số lớp electron tăng.
II. XU HƯỚNG BIẾN ĐỔI ĐỘ ÂM ĐIỆN, TÍNH KIM LOẠI VÀ TÍNH PHI KIM.
1. Độ âm điện
GV đưa ra câu hỏi:
- Nêu khái niệm độ âm điện?
- Trong một chu kì, độ âm điện có xu hướng như thế nào khi đi từ trái qua phải theo chiều tăng của điện tích hạt nhân?
- Trong một nhóm A, độ âm điện có xu hướng như thế nào khi đi từ trên xuống dưới theo chiều tăng dần của điện tích hạt nhân?
Nội dung ghi nhớ:
Độ âm điện là đại lượng đặc trưng cho khả năng hút electron liên kết của một nguyên tử trong phân tử.
a, Cặp electron liên kết của phân tử H2 không bị lệch về phía nguyên tử nào vì độ âm điện của 2 nguyên tử H là giống nhau.
b, Cặp electron liên kết trong phân tử NH3 và H2O bị lệch nhiều hơn về phía các nguyên tử N và O vì N và O có độ âm điện lớn hơn H.
c, Trong một chu kì đi từ trái qua phải theo chiều tăng của điện tích hạt nhân thì độ âm điện có xu hướng tăng dần vì điện tích hạt nhân tăng đồng thời bán kính nguyên tử giảm làm khả năng hút cặp electron liên kết càng mạnh.
d, Trong một nhóm A, đi từ trên xuống dưới theo chiều tăng dần của điện tích hạt nhân, độ âm điện có xu hướng giảm dần vì sự tăng nhanh của bán kính nguyên tử làm lực hút của hạt nhân tới cặp electron liên kết càng yếu.
e, Độ âm điện của nguyên tố X (Z=14) nhỏ hơn độ âm điện của nguyên tố Y (Z=16). Vì 2 nguyên tố này thuộc cùng một chu kì, nhưng nguyên tố Y có điện tích hớn hơn X.
2. Tính kim loại, tính phi kim.
GV đưa ra câu hỏi: Trong một chu kì, trong một nhóm (nhóm A), xu hướng biến đổi độ âm điện và tính kim loại, phi kim của nguyên tử các nguyên tố là như thế nào? Giải thích?
Nội dung ghi nhớ:
a,
- Trong một chu kì, từ trái sang phải, điện tích hạt nhân tăng dần, bán kính nguyên tử giảm dần nên lực hút của hạt nhân tới electron hóa trị tăng, làm tăng khả năng nhận electron, do đó, tính phi kim của nguyên tố tăng dần.
- Trong một nhóm A, mặc dù điện tích hạt nhân tăng dần nhưng do bán kính nguyên tử của các nguyên tố tăng nhanh, nên lực hút của hạt nhân tới electron hóa trị giảm dần, làm giảm khả năng nhận thêm electron, do đó tính phi kim giảm.
b,
- Nguyên tử càng dễ nhường electron thì tính kim loại càng tăng.
- Nguyên tử càng dễ nhận electron thì tính kim loại càng giảm.
- Trong một chu kì, từ trái qua phải (theo chiều Z tăng) thì tính kim loại có xu hướng giảm dần và tinh phi kim có xu hướng tăng dần vì khả năng nhường electron giảm, khả năng nhận electron tăng.
- Trong một nhóm A, từ trên xuống dưới (theo chiều Z tăng) thì tính kim loại có xu hướng tăng dần và tính phi kim có xu hướng giảm dần vì khả năng nhường electron tăng, khả năng nhận electron giảm.
Tính phi kim của các nguyên tố O, S, F được sắp xếp theo chiều tăng dần:
F > O > S . Vì O (Z = 8) và F (Z = 9) thuộc cùng một chu kì. Theo chiều điện tích hạt nhân tăng dần ta được tính phi kim F > O . O và S thuộc cùng một nhóm A. Theo chiều điện tích hạt nhân tăng dần ta được tính phi kim O > S.
C. HOẠT ĐỘNG LUYỆN TẬP
- Hoàn thành bài tập trắc nghiệm sau:
Câu 1: Dãy sắp xếp theo thứ tự tăng dần độ âm điệncủa các nguyên tố Mg, Al, B và C là
A. B < Mg < Al < C
B. Mg < Al < B < C
C. Mg < B < Al < C
D. Al < B < Mg < C
Câu 2: Hydroxide nào có tính base mạnh nhất trong các hydroxide sau đây? Cho biết hợp chất này được sử dụng làm chất phụ gia cho dầu bôi trơn của động cơ đốt trong.
A. Strontium hydroxide.
B. Barium hydroxide.
C. Calcium hydroxide.
D. Magnesium hydroxide.
Câu 3: Trong các acid dưới đây, acid nào mạnh nhất ?
A. H3PO4.
B. H2SO4.
C. H2SiO3.
D. HClO4.
Câu 4: Cation R+ có cấu hình electron 1s22s22p63s23p6. Vị trí của nguyên tố R trong bảng tuần hoàn các nguyên tố hóa học là
A. chu kì 3, nhóm VIIA.
B. chu kì 4, nhóm IIA.
C. chu kì 3, nhóm VIIIA.
D. chu kì 4, nhóm IA.
Câu 5: Khoảng cách trung bình giữa hạt nhân và electron lớp ngoài cùng được gọi là
A. Khối lượng nguyên tử.
B. Số nguyên tử.
C. Bán kính nguyên tử.
D. Độ âm điện.
Gợi ý đáp án:
| Câu | 1 | 2 | 3 | 4 | 5 |
| Đáp án | B | B | D | D | C |
D. HOẠT ĐỘNG VẬN DỤNG
Vận dụng kiến thức, GV yêu cầu HS trả lời câu hỏi:
Câu 1: Xác định vị trí của Y trong bảng tuần hoàn biết anion Y- có cấu hình electron 1s22s22p63s23p6.
Câu 2: Cho các nguyên tố 4Be, 11Na, 12Mg, 19K. Tính bazơ của các hydroxide được xếp theo thứ tự nào?
