Slide bài giảng hóa học 10 cánh diều bài 3: Nguyên tố hóa học
Slide điện tử bài 3: Nguyên tố hóa học. Trình bày với các hiệu ứng hiện đại, hấp dẫn. Giúp học sinh hứng thú học bài. Học nhanh, nhớ lâu. Có tài liệu này, hiệu quả học tập của môn Hóa học 10 Cánh diều sẽ khác biệt
Bạn chưa đủ điều kiện để xem được slide bài này. => Xem slide bài mẫu
Tóm lược nội dung
BÀI 3. NGUYÊN TỐ HÓA HỌC
KHỞI ĐỘNG
- GV cho HS viết ra những điều đã biết, chưa biết và muốn biết về nguyên tố hóa học rồi sẽ cùng nhau giải quyết từng vấn đề trong tiết học hôm nay.
NỘI DUNG BÀI HỌC GỒM
- NGUYÊN TỐ HÓA HỌC.
- Khái niệm nguyên tố hóa học.
- Số hiệu nguyên tử, số khối, kí hiệu nguyên tử.
- ĐỒNG VỊ, NGUYÊN TỬ KHỐI TRUNG BÌNH.
- Đồng vị.
- Nguyên tử khối trung bình.
HÌNH THÀNH KIẾN THỨC
I. NGUYÊN TỐ HÓA HỌC.
1. Khái niệm nguyên tố hóa học
GV yêu cầu HS hoạt động nhóm 2 trả lời câu hỏi:
- Nêu khái niệm nguyên tố hóa học?
- Quan sát hình 3.2, so sánh về cấu tạo của 3 nguyên tử H.
Nội dung ghi nhớ:
- Nguyên tố hóa học là tập hợp các nguyên tử có cùng số hạt proton.
- So sánh:
+ Giống: đều có 1 proton và 1 electron trong nguyên tử.
+ Khác:
Nguyên tử H thứ nhất không có neutron.
Nguyên tử H thứ hai chứa 1 neutron.
Nguyên tử H thứ ba chứa 2 neutron.
2. Số hiệu nguyên tử, số khối, kí hiệu nguyên tử
GV đưa ra câu hỏi:
- Nêu khái niệm và kí hiệu của số hiệu nguyên tử?
- Nêu khái niệm số khối? Số khối được tính như thế nào?
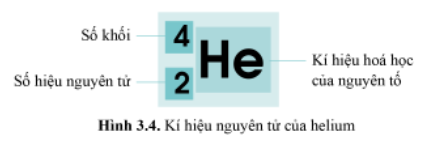
- Nêu cách viết, ý nghĩa của kí hiệu nguyên tử? Cho ví dụ.
Nội dung ghi nhớ:
- Số proton trong mỗi hạt nhân nguyên tử được gọi là số hiệu nguyên tử, kí hiệu là Z.
- Số khối là tổng số proton (Z) và neutron (N) trong một hạt nhân nguyên tử , kí hiệu là A.
Công thức: A= Z+N
- Kí hiệu nguyên tử: ZAX
Ý nghĩa: cho biết kí hiệu hóa học của nguyên tố (X), số hiệu nguyên tử Z và số khối A.
Ví dụ hình 3.4
II. ĐỒNG VỊ, NGUYÊN TỬ KHỐI TRUNG BÌNH
1. Đồng vị
GV yêu cầu học sinh hoạt động theo nhóm:
- Điền đáp án phiếu học tập.
- Đồng vị là gì. Lấy ví dụ.
Nội dung ghi nhớ:
Đáp án phiếu học tập:
1. 11H : Nguyên tử H có điện tích hạt nhân là 1 và số khối là 1
=> số neutron = 0
12H : Nguyên tử H có điện tích hạt nhân là 1 và số khối là 2
=> số neutron = 1
13H : Nguyên tử H có điện tích hạt nhân là 1 và số khối là 3
=> số neutron = 2
2. Khái niệm đồng vị: Các nguyên tử của cùng một nguyên tố hóa học có cùng số neutron khác nhau là đồng vị của nhau.
3. Nguyên tử M và T là đồng vị của nhau.
2. Nguyên tử khối trung bình
GV đưa ra câu hỏi:
- Nêu khái niệm, kí hiệu của nguyên tử khối trung bình?
- Nguyên tử khối trung bình được tính như thế nào?
Nội dung ghi nhớ:
- Nguyên tử khối là khối lượng tương đối của của một nguyên tử, cho biết khối lượng của một nguyên tử nặng gấp bao nhiêu lần 1 amu.
- Nguyên tử khối của nguyên tố hóa học có nhiều đồng vị là nguyên tử khối trung bình của đồng vị kí hiệu là A
Công thức tính nguyên tử khối trung bình: 
Trong đó:
X, Y, Z… lần lượt là số khối của các đồng vị
x, y, z … là phần trăm số nguyên tử các đồng vị tương ứng.
C. HOẠT ĐỘNG LUYỆN TẬP
- Hoàn thành bài tập trắc nghiệm sau:
Câu 1: Trong tự nhiên Chlorine có hai đồng vị bền: 37Cl chiếm 24,23% tổng số nguyên tử, còn lại là 35Cl. Thành phần % theo khối lượng của 37Cl trong HClO4 là
A. 8,92%.
B. 8,79%.
C. 8,43%.
D. 8,56%.
Câu 2: Hạt nhân của nguyên tử nào có số hạt neutron là 28?
A. ![]() .
.
B. ![]() .
.
C. ![]() .
.
D. ![]() .
.
Câu 3: Một nguyên tử có 29 proton, 36 neutron và 29 electron. Số hiệu nguyên tử và số khối của nguyên tử có giá trị:
A. Số hiệu nguyên tử = 36, số khối = 65.
B. Số hiệu nguyên tử = 16, số khối = 36.
C. Số hiệu nguyên tử = 29, số khối = 65.
D. Số hiệu nguyên tử = 29, số khối = 36.
Câu 4: Cho các cặp nguyên tử sau. Đáp án nào chứa cặp đồng vị của cùng một nguyên tố hóa học?
A. Nguyên tử A: 13 proton, 13 neutron và 12 electron. Nguyên tử B: 14 proton, 12 neutron và 13 electron.
B. Nguyên tử A: 13 proton, 12 neutron và 12 electron. Nguyên tử B: 12 proton, 12 neutron và 12 electron.
C. Nguyên tử A: 12 proton, 12 neutron và 12 electron. Nguyên tử B: 12 proton, 13 neutron và 12 electron.
D. Nguyên tử A: 12 proton, 12 neutron và 12 electron. Nguyên tử B: 12 proton, 12 neutron và 13 electron.
Câu 5: Trong tự nhiên Magnesium có 3 đồng vị bền 24Mg chiếm 78,99%, 25Mg chiếm 10,00% và 26Mg. Nguyên tử khối trung bình của Magnesium là
A. 24,89.
B. 24,11.
C. 24,32.
D. 24,00.
Gợi ý đáp án:
| Câu | 1 | 2 | 3 | 4 | 5 |
| Đáp án | A | B | C | C | C |
D. HOẠT ĐỘNG VẬN DỤNG
Vận dụng kiến thức, GV yêu cầu HS trả lời câu hỏi:
Câu 1: Nguyên tử X có tổng các loại hạt cơ bản là 52, trong đó số hạt mang điện gấp 1,889 lần số hạt không mang điện. Hãy cho biết số hạt mang điện của nguyên tử X là bao nhiêu?
Câu 2: Trong tự nhiên, nguyên tử Chlorine có hai đồng vị bền là 35Cl và 37Cl. Tại sao nguyên tử khối tương đối của Chlorine thường được sử dụng là 35,5?
