Slide bài giảng hóa học 10 cánh diều bài 5: Lớp, phân lớp và cấu hình electron
Slide điện tử bài 5: Lớp, phân lớp và cấu hình electron. Trình bày với các hiệu ứng hiện đại, hấp dẫn. Giúp học sinh hứng thú học bài. Học nhanh, nhớ lâu. Có tài liệu này, hiệu quả học tập của môn Hóa học 10 Cánh diều sẽ khác biệt
Bạn chưa đủ điều kiện để xem được slide bài này. => Xem slide bài mẫu
Tóm lược nội dung
BÀI 5. LỚP, PHÂN LỚP VÀ CẤU HÌNH ELECTRON
KHỞI ĐỘNG
- GV sử dụng hình 5.1 sgk trang 26, yêu cầu HS quan sát và trả lời câu hỏi:
- Các nguyên tử có số hiệu nguyên tử Z ≥ 2 có số electron tối đa ở lớp K là bao nhiêu?
- Số thứ tự phân bố electron vào lớp vỏ electron như thế nào?
- Trong mỗi lớp, số electron tối đa là bao nhiêu?
NỘI DUNG BÀI HỌC GỒM
- LỚP VÀ PHÂN LỚP ELECTRON
- Lớp electron
- Phân lớp electron
- CẤU HÌNH ELECTRON NGUYÊN TỬ.
- Cách viết cấu hình electron nguyên tử
- Biểu diễn cấu hình electron theo ô orbital.
HÌNH THÀNH KIẾN THỨC
I. LỚP VÀ PHÂN LỚP ELECTRON
1. Lớp electron
GV yêu cầu HS hoạt động nhóm 4 trả lời câu hỏi:
- Các electron trong lớp vỏ nguyên tử được phân bố dựa vào các lớp và phân lớp theo yếu tố nào?
- Mức năng lượng của các electron trên mỗi lớp có đặc điểm gì?
- Dựa vào bảng 5.1 sgk, nhận xét về mối quan hệ giữa số lượng AO và số electron tối đa trên mỗi lớp. Rút ra quy tắc xác định số electron và số AO trong lớp electron thứ n (n ≤ 4).
Nội dung ghi nhớ:
(1) Các electron trong lớp vỏ nguyên tử được phân bố vào các lớp và phân lớp dựa theo yêu tố năng lượng của chúng.
(2) Các electron thuộc cùng một lớp có năng lượng gần bằng nhau.
(3)
- Lớp K n=1 có 1 AO với số electron tối đa là 2.
- Lớp L n=2 có 4 AO với số electron tối đa là 8.
- Lớp M n=3 có 9 AO với số electron tối đa là 9.
- Lớp N có n=4 có 32 AO với số electron tối đa là 32.
=> Nhận xét: Lớp AO thứ n có n2 AO.
Lớp thứ n có tối đa 2n2AO.
2. Phân lớp electron
GV yêu cầu học sinh chia nhóm hoạt động trả lời câu hỏi:
- Hãy cho biết nguyên tắc được chia thành các phân lớp trong mỗi lớp electron?
- Hãy nêu số lượng và kí hiệu các phân lớp trong một phân lớp.
- Trong mỗi phân lớp s, p, d, f, số lượng AO là bao nhiêu?
- Hãy rút ra cách biểu diễn số electron tối đa trong mỗi phân lớp.
- Số electron tối đa cho các phân lớp sau: 3p, 4s, 5d, 6f được biểu diễn như thế nào?
Nội dung ghi nhớ:
- Mỗi lớp electron (trừ lớp thứ nhất) được chia thành các phân lớp theo nguyên tắc: Các electron thuộc cùng một phân lớp có năng lượng bằng nhau.
- Lớp electron thứ n có n phân lớp và được kí hiệu lần lượt là ns, np, nd, nf,... Cụ thể:
- Lớp K, n= 1: có 1 phân lớp, được kí hiệu là 1s.
- Lớp L, n=2: có 2 phân lớp được kí hiệu là 2s và 2p.
- Lớp M, n=3: có 3 phân lớp, được kí hiệu là 3s, 3p, 3d.
- Số lượng AO trong mỗi phân lớp:
- Phân lớp ns chỉ có 1 AO.
- Phân lớp np có 3 AO.
- Phân lớp nd có 5 AO.
- Phân lớp nf có 7 AO.
- Số electron trong mỗi phân lớp được biểu diễn bằng chỉ số phía trên, bên trái kí hiệu phân lớp. Phân lớp nào đã có tối đa electron thì được gọi là phân lớp bão hòa.
II. CẤU HÌNH ELECTRON NGUYÊN TỬ.
1. Cách viết cấu hình electron nguyên tử
GV đưa ra câu hỏi: Nêu cách viết và thứ tự viết cấu hình electron nguyên tử.
Nội dung ghi nhớ:
- Cấu hình electron cho biết thứ tự mức năng lượng các electron giữa các phân lớp. Năng lượng của electron trong mỗi phân lớp tăng theo chiều từ trái qua phải.
Ví dụ: Trong nguyên tử Li, năng lượng của electron thuộc phân lớp 2s cao hơn electron thuộc phân lớp 1s.
2. Biểu diễn cấu hình electron theo ô orbital.
GV đặt câu hỏi yêu cầu học sinh suy nghĩ trả lời: Vì sao hai electron trong cùng một AO sẽ đẩy nhau?
Nội dung ghi nhớ:
- Electron mang điện tích âm nên hai electron trong cùng một AO sẽ đẩy nhau, vì vật chúng có xu hướng tách nhau ra chiếm hai AO khác nhau.
C. HOẠT ĐỘNG LUYỆN TẬP
- Hoàn thành bài tập trắc nghiệm sau:
Câu 1: Cho cấu hình electron nguyên tử của các nguyên tố sau:
X. 1s2 2s2 2p6 3s2; Y. 1s2 2s2 2p6 3s2 3p6 4s1;
Z. 1s2 2s2 2p6 3s2 3p3; T. 1s2 2s2 2p6 3s2 3p6 3d8 4s2;
Dãy cấu hình electron của các nguyên tử nguyên tố kim loại là
A. X, Y, Z.
B. X, Y, T.
C. X, Z, T.
D. Y, Z, T.
Câu 2: Một ion R3+ có phân lớp cuối cùng là 3d5. Cấu hình electron của nguyên tử R là
A. 1s2 2s2 2p6 3s2 3p2 4s2 3d8.
B. 1s2 2s2 2p6 3s2 3p6 3d6 4s2.
C. 1s2 2s2 2p6 3s2 3p6 3d5 4s2 4p1.
D. 1s2 2s2 2p6 3s2 3p6 3d5 4s3.
Câu 3: Cấu hình electron nào sau đây không đúng?
A. 1s22s22p63s2.
B. 1s22s22p63s23p5.
C. 1s22s22p5.
D. 1s22s22p63s23p34s2.
Câu 4. Cấu hình theo ô orbital của một số nguyên tố được cho dưới đây. Cấu hình electron của nguyên tử nguyên tố là
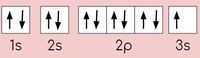
A. 1s2 2s2 2p5 3s1.
B. 1s1 2s1 2p3 3s1.
C. 1s22s22p63s2.
D. 1s22s22p63s1.
Câu 5: Nguyên tử nguyên tố Y có tổng số electron trên các phân lớp p là 11. Nguyên tố Y là
A. Potassium (Z = 19).
B. Chlorine (Z = 17).
C. Fluorine (Z = 9).
D. Sulfur (Z = 16).
Gợi ý đáp án:
| Câu | 1 | 2 | 3 | 4 | 5 |
| Đáp án | B | B | D | D | B |
D. HOẠT ĐỘNG VẬN DỤNG
Vận dụng kiến thức, GV yêu cầu HS trả lời câu hỏi:
Câu 1: Cấu hình electron ở trạng thái cơ bản của nguyên tử kim loại nào sau đây có electron độc thân ở orbital s? (Cho số hiệu nguyên tử của Cr = 24, Ni = 28, Co = 27, Fe = 26).
Câu 2: Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3s. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3s và có 5 electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 3. Tìm nguyên tố X, Y?
