Lý thuyết trọng tâm hóa học 11 kết nối bài 16: Hydrocarbon không no
Tổng hợp kiến thức trọng tâm hóa học 11 kết nối bài 16: Hydrocarbon không no. Tài liệu nhằm củng cố, ôn tập lại nội dung kiến thức bài học cho học sinh dễ nhớ, dễ ôn luyện. Kéo xuống để tham khảo
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
I. KHÁI NIỆM, ĐỒNG PHÂN, DANH PHÁP
1. Khái niệm và công thức chung của alkene, alkyne
CT chung | Các loại liên kết | |
Alkene | C$_{n}$H$_{2n}$ (n ≥2 ) | LK đơn và 1 LK đôi C=C |
Alkyne | C$_{n}$H$_{2n-2}$ (n ≥ 2) | LK đơn và 1 LK ba C≡C |
2. Đồng phân
a) Đồng phân cấu tạo
- Đồng phân vị trí liên kết đôi, liên kết ba
- Đồng phân mạch carbon
b) Đồng phân hình học
HĐ1. Điều kiện để có đồng phân hình học của alkene là a ≠ b và c ≠ d
(Trong phân tử alkene mỗi nguyên tử Carbon của liên kết đôi nối với hai nguyên tử hoặc hai nhóm nguyên tử khác nhau có đồng phân cis-trans.)
HĐ2. Alkene 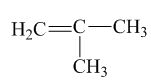 không có đồng phân hình học vì:
không có đồng phân hình học vì:
C của liên kết đôi liên kết với hai nguyên tử giống nhau (hydrogen) và 2 nhóm nguyên tử giống nhau (CH$_{3}$).
Kết luận
- Alkene, alkyne có các đồng phân cấu tạo (Đồng phân vị trí liên kết bội; đồng phân mạch carbon từ C4 đối với alkene và từ C5 đối với alkyne)
- Alkene từ C4 có thể có đồng phân hình học
3. Danh pháp
- Tên thay thế alkene: Phần nền – vị trí liên kết đôi – ene
- Tên thay thế alkyne: Phần nền – vị trí liên kết ba – yne
Lưu ý:
- Chọn mạch carbon dài nhất, có nhiều nhánh nhất và có chưa liên kết bội làm mạch chính.
- Đánh số sao cho nguyên tử carbon có liên kết bội có chỉ số nhỏ nhất.
- Dùng chỉ số (1, 2, 3, …) và gạch nối (-) để chỉ vị trí liên kết bội.
- Nếu hợp chất có nhánh thì cần thêm vị trí nhánh và tên nhánh trước tên hợp chất mạch chính.
Ví dụ:
C5H10có các CTCT sau:
- CH2 = CHCH2CH2CH3: pent-1-ene
- CH3CH=CHCH2CH3: pent-2-ene
- CH2=C(CH3)CH2CH3: 2-methylbut-1-ene
- CH2 = CHCH(CH3)2: 3-methylbut-1-ene
- (CH3)2C=CHCH3: 2-methylbut-2- ene
C5H8 có các CTCT sau:
- CH ≡ CCH2CH2CH3: pent - 1 - yne
- CH3C ≡ CCH2CH3: pent -2 - yne
- CH ≡ CHCH2CH2CH3: pent -1- yne
- CH ≡ CCH(CH3)2: 3-methylbut -1- yne
II. ĐẶC ĐIỂM CẤU TẠO CỦA ETHYLENE VÀ ACETYLENE
Đặc điểm liên kết, hình dạng phân tử | ||
Góc ∠CCH | Đặc điểm LK giữa 2 ngtử C | |
Ethylene | 121,30 | 1 LK σ và 1 LK π |
Acetylene | 1800 | 1 LK σ và 2 LK π |
Kết luận: Phân tử alkene và alkyne chứa liên kết π kém bền → dễ bị phá vỡ khi tham gia phản ứng hoá học.
III. TÍNH CHẤT VẬT LÍ
- Ở điều kiện thường các alkene, alkyne từ C2-C4 ở thể khí (trừ but-2-yne ở thể lỏng), từ C5 trở lên ở thể lỏng hoặc rắn.
- Đều nhẹ hơn nước, không tan hoặc ít tan trong nước, chỉ tan trong các số dung môi không phân cực, …
- Không có mùi.
- Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng của alkene, alkyne tăng dần khi số nguyên tử carbon trong phân tử tăng dần
IV. TÍNH CHẤT HOÁ HỌC
Trung tâm phản ứng của alkene và alkyne là liên kết bội → bẻ gãy liên kết π có trong liên kết bội. Phản ứng đặc trưng của alkene và alkyne là phản ứng cộng, trùng hợp, oxi hoá.
1. Phản ứng cộng
a) Cộng hydrogen
CH2=CH2+H2 $\overset{Ni,t^{o}}{\rightarrow }$ CH3-CH3
(C2H4+H2 $\overset{Ni,t^{o}}{\rightarrow }$ C2H6)
HC≡CH + 2H2 $\overset{Ni,t^{o}}{\rightarrow }$ CH3-CH3
(C2H2 + 2H2 $\overset{Ni,t^{o}}{\rightarrow }$ C2H6)
Tổng quát:
CnH2n + H2 $\overset{Ni,t^{o}}{\rightarrow }$ CnH2n+2
CnH2n - 2 + H2 $\overset{Ni,t^{o}}{\rightarrow }$ CnH2n+2
b) Cộng halogen
CH2=CH2 + Br2 → Br-CH2-CH2-Br (C2H4+Br2 → C2H4Br2)
HC≡CH + 2Br2 →Br2CH-CHBr2 (C2H2 + 2Br2 → C2H2Br4)
Tổng quát:
CnH2n + X2 → CnH2nX2
CnH2n - 2 + 2X2 → CnH2n - 2X4
c) Cộng hydrogene halide
CH2=CH2 + HBr→ CH3-CH2-Br
(C2H4+HBr→ C2H5Br)
HC≡CH + HBr → CH2=CHBr
(C2H2+ HBr→ C2H3Br)
HC≡CH + 2HBr → CH3CHBr2
(C2H2+ 2HBr→ C2H4Br2)
d) Phản ứng cộng nước
CH2=CH2 + H2O ![]() CH3CH2OH
CH3CH2OH
HC≡CH + H2O ![]() CH3CHO
CH3CHO
Quy tắc Markovnikov: Khi cộng một tác nhân bất đối xứng vào một alkene bất đối xứng thì phần điện tích dương của tác nhân ưu tiên tấn công vào C mang liên kết đôi có nhiều H hơn (bậc thấp hơn), còn nguyên tử hay nhóm nguyên tử mang điện tích âm cộng vào nguyên tử cacbon bậc cao hơn.
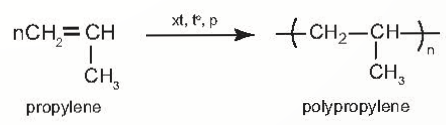
2. Phản ứng trùng hợp của alkene
Monomer $\overset{t^{o},p,xt}{\rightarrow }$ polimer (n: hệ số trùng hợp)
VD: phản ứng trùng hợp propylene
3. Phản ứng của alk - 1 - yne với AgNO3 trong NH3
Hiện tượng: xuất hiện kết tủa màu vàng nhạt
PTHH: HC ≡ CH + 2AgNO3 + 2NH3 → AgC ≡ CAg↓ + 2NH4NO3
=> Phản ứng thường dùng để nhận biết alk-1-yne
4. Phản ứng oxi hóa
a. Phản ứng oxi hoá không hoàn toàn
Hiện tượng: Cả ethylene và acetylene đều có khả năng làm mất màu dung dịch KMnO4
PTHH:
3CH2=CH2 + 2KMnO4 + 4H2O → 3HO–CH2–CH2–OH + 2MnO2↓ + 2KOH
3C2H2 + 8KMnO4 → 3(COOK)2 + 8MnO2 ↓ + 2KOH + 2H2O
Nhận xét: alkene, alkyne có khả năng làm mất màu dung dịch KMnO4 (Phản ứng oxi hoá không hoàn toàn)
b. Phản ứng oxi hoá hoàn toàn
PT tổng quát:
CnH2n + $\frac{3n}{2}$O2 → nCO2 + nH2O
Số mol CO2 = số mol H2O
CnH2n-2 + $\frac{3n-1}{2}$O2 → nCO2 + (n-1)H2O
Số mol CO2 > số mol H2O
Thí nghiệm kiểm chứng tính chất hoá học của alkene, alkyne
Thí nghiệm 1: Điều chế và thử tính chất hóa học của ethylene
Hiện tượng: Khí sinh ra làm mất màu dung dịch bromine và thuốc tím.
C2H5OH $\overset{H_{2}SO_{4},t^{o}}{\rightarrow }$ C2H4 + H2O.
CH2=CH2 + Br2 → CH2Br–CH2Br
màu nâu đỏ không màu
3CH2=CH2 + 4H2O + 2KMnO4 → 3HO–CH2–CH2–OH + 2MnO2 + 2KOH
Khi dùng que đóm đốt ethylene ở đầu ống dẫn khí, ethylene sinh ra cháy trong không khí và tỏa nhiều nhiệt
C2H4+ 3O2 $\overset{t^{o}}{\rightarrow }$ 2CO2 + 2H2O
Thí nghiệm 2: Điều chế và thử tính chất hóa học của acetylene
Hiện tượng: Khí sinh ra làm mất màu dung dịch bromine/thuốc tím.
CaC2 + H2O → C2H2 + Ca(OH)2
CH≡CH + Br2 → CHBr=CHBr
CHBr=CHBr + Br2 → CBr2-CBr2
CH≡CH + KMnO4 + H2O → (COOH)2 + MnO2 + KOH
Khi dùng que đóm đốt acetylene ở đầu ống dẫn khí, acetylene sinh ra cháy trong không khí và tỏa nhiều nhiệt
C2H2+ 5/2O2 $\overset{t^{o}}{\rightarrow }$ 2CO2 + H2O
V. ĐIỀU CHẾ
1. Điều chế trong phòng thí nghiệm:
C2H5OH ![]() C2H4 + H2O
C2H4 + H2O
CaC2 + 2H2O → C2H2 + Ca(OH)2
2. Điều chế trong CN:
Cracking alkane → alkene:
VD: C15H32 ![]() 2C2H4 + C3H6 + C8H18
2C2H4 + C3H6 + C8H18
Điều chế acetylene chủ yếu từ CH4 hoặc CaC2:
2CH4 ![]() C2H2 + 3H2
C2H2 + 3H2
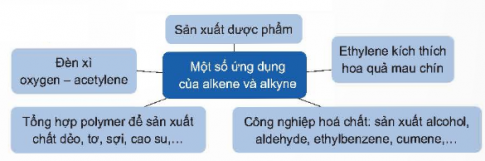
VI. ỨNG DỤNG
- Alkene, alkyne là nguyên liệu tổng hợp các chất hữu cơ, dùng làm nhiên liệu.
- Acetylene được dùng làm nhiên liệu trong đèn xì oxy-acetylene để hàn cắt kim loại
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
Giải bài tập những môn khác
Giải sgk lớp 11 KNTT
Giải sgk lớp 11 CTST
Giải sgk lớp 11 cánh diều
Giải SBT lớp 11 kết nối tri thức
Giải SBT lớp 11 chân trời sáng tạo
Giải SBT lớp 11 cánh diều
Giải chuyên đề học tập lớp 11 kết nối tri thức
Giải chuyên đề toán 11 kết nối tri thức
Giải chuyên đề ngữ văn 11 kết nối tri thức
Giải chuyên đề vật lí 11 kết nối tri thức
Giải chuyên đề hóa học 11 kết nối tri thức
Giải chuyên đề sinh học 11 kết nối tri thức
Giải chuyên đề kinh tế pháp luật 11 kết nối tri thức
Giải chuyên đề lịch sử 11 kết nối tri thức
Giải chuyên đề địa lí 11 kết nối tri thức
Giải chuyên đề mĩ thuật 11 kết nối tri thức
Giải chuyên đề âm nhạc 11 kết nối tri thức
Giải chuyên đề công nghệ chăn nuôi 11 kết nối tri thức
Giải chuyên đề công nghệ cơ khí 11 kết nối tri thức
Giải chuyên đề tin học 11 định hướng Khoa học máy tính kết nối tri thức
Giải chuyên đề tin học 11 định hướng Tin học ứng dụng kết nối tri thức
Giải chuyên đề quốc phòng an ninh 11 kết nối tri thức
Giải chuyên đề hoạt động trải nghiệm hướng nghiệp 11 kết nối tri thức
Giải chuyên đề học tập lớp 11 chân trời sáng tạo
Giải chuyên đề học tập lớp 11 cánh diều
Trắc nghiệm 11 Kết nối tri thức
Trắc nghiệm 11 Chân trời sáng tạo
Trắc nghiệm 11 Cánh diều
Bộ đề thi, đề kiểm tra lớp 11 kết nối tri thức
Đề thi Toán 11 Kết nối tri thức
Đề thi ngữ văn 11 Kết nối tri thức
Đề thi vật lí 11 Kết nối tri thức
Đề thi sinh học 11 Kết nối tri thức
Đề thi hóa học 11 Kết nối tri thức
Đề thi lịch sử 11 Kết nối tri thức
Đề thi địa lí 11 Kết nối tri thức
Đề thi kinh tế pháp luật 11 Kết nối tri thức
Đề thi công nghệ cơ khí 11 Kết nối tri thức
Đề thi công nghệ chăn nuôi 11 Kết nối tri thức
Đề thi tin học ứng dụng 11 Kết nối tri thức
Đề thi khoa học máy tính 11 Kết nối tri thức
Bộ đề thi, đề kiểm tra lớp 11 chân trời sáng tạo
Bộ đề thi, đề kiểm tra lớp 11 cánh diều
Đề thi Toán 11 Cánh diều
Đề thi ngữ văn 11 Cánh diều
Đề thi vật lí 11 Cánh diều
Đề thi sinh học 11 Cánh diều
Đề thi hóa học 11 Cánh diều
Đề thi lịch sử 11 Cánh diều
Đề thi địa lí 11 Cánh diều
Đề thi kinh tế pháp luật 11 Cánh diều
Đề thi công nghệ cơ khí 11 Cánh diều
Đề thi công nghệ chăn nuôi 11 Cánh diều
Đề thi tin học ứng dụng 11 Cánh diều
Đề thi khoa học máy tính 11 Cánh diều

Bình luận