Lý thuyết trọng tâm hóa học 11 cánh diều bài 16: Alcohol
Tổng hợp kiến thức trọng tâm hóa học 11 cánh diều bài 16: Alcohol. Tài liệu nhằm củng cố, ôn tập lại nội dung kiến thức bài học cho học sinh dễ nhớ, dễ ôn luyện. Kéo xuống để tham khảo
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
I. KHÁI NIỆM VÀ DANH PHÁP
1. Khái niệm
Alcohol là những hợp chất hữu cơ trong phân tử có nhóm hydroxy (-OH) liên kết trực tiếp với nguyên tử carbon no.
Trả lời Câu hỏi 1 SGK trang 108:
a) Trong phân tử các chất trên có chứa một hay nhiều nhóm (-OH)
b) Hợp chất E không phải alcohol
Alcohol được phân loại theo nhiều cách khác nhau:
- Theo liên kết carbon:
- Alcohol no: CH3CH2OH,

- Alcohol không no: CH2=CH-CH2-OH
- Alcohol thơm:

- Theo số nhóm chức hydroxy:
- Monoalcohol: CH3OH
- Polyalcohol: HOCH2CH2OH
Bậc của alcohol (bậc một, bậc hai và bậc ba) chính là bậc của nguyên tử carbon
Ví dụ:
- Alcohol bậc một: CH3-CH2-CH2-OH
- Alcohol bậc hai:
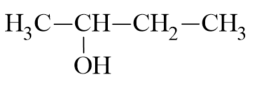
- Alcohol bậc ba:

- Alcohol no, đơn chức, mạch hở có công thức tổng quát là CnH2n+1OH (n ≥ 1)
2. Danh pháp
Tên thay thế: Nhóm hydroxy là nhóm thế gắn vào mạch chính của hydrocarbon. Đánh số thứ tự nguyên tử carbon trong mạch chính sao cho vị trí của nguyên tử carbon liên kết với nhóm hydroxy là nhỏ nhất.
- Tên của monoalcohol: Tên hydrocarbon (bỏ e) – số chỉ vị trí nhóm –OH – ol
Ví dụ:
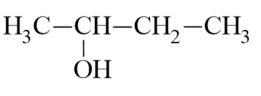 butan-2-ol
butan-2-ol
- Tên của polyalcohol: Tên hydrocarbon – số chỉ vị trí nhóm –OH – từ chỉ số lượng nhóm –OH (di, tri,...) ol
 buta-1,3-diol
buta-1,3-diol
- Tên thông thường:
 isobutyl alcohol
isobutyl alcohol- CH2=CH-CH2-OH allyl alcohol
 ethylene glycol
ethylene glycol- C6H5-CH2-OH benzyl alcohol
II. TÍNH CHẤT VẬT LÍ
Do tạo được liên kết hydrogen liên phân tử nên các alcohol có nhiệt độ sôi cao hơn các hydrocarbon hoặc dẫn xuất halogen có phân tử khối tương đương
Nhiệt độ sôi và khối lượng riêng của các alcohol tăng dần khi phân tử khối tăng
Khi nguyên tử carbon tăng lên thì độ tan của alcohol trong nước giảm dần
III. TÍNH CHẤT HOÁ HỌC
1. Phản ứng thế nguyên tử hydrogen trong nhóm – OH
Khi cho một mẩu sodium vào ống nghiệm có chứa ethyl alcohol thì thấy phản ứng xảy ra, giải phóng ra khí hydrogen:
2C2H5–OH + 2Na → 2C2H5–ONa + H2
2. Phản ứng thế nhóm – OH tạo ether
C2H5O–H + HO–C2H5 $\overset{t^{o},xt}{\rightarrow}$ C2H5OC2H5 + H2O
3. Phản ứng tách H2O tạo alkene
H–CH2–CH2–OH $\overset{t^{o},xt}{\rightarrow}$ CH2=CH2 + H2O
4. Phản ứng oxi hóa
a) Phản ứng oxi hóa hoàn toàn
Thí nghiệm 1. Đốt cháy ethyl alcohol
Hiện tượng: Ethanol cháy mạnh trong không khí, phản ứng tỏa nhiều nhiệt.
Phương trình hóa học:
C2H5OH (l) + 3O2(g) $\overset{t^{o}}{\rightarrow}$ 2CO2(g) + 3H2O(g)
b) Phản ứng oxi hóa không hoàn toàn
Alcohol bậc một bị oxi hóa bằng CuO sinh ra aldehyde
CH3-CH2-OH + CuO $\overset{t^{o}}{\rightarrow}$ CH3-CH=O + Cu + H2O
Alcohol bậc hai bị oxi hóa sinh ra ketone
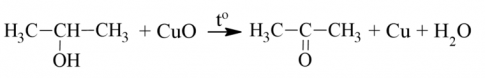
Alcohol bậc ba không bị oxi hóa
5. Phản ứng riêng của glycerol
Thí nghiệm 2. Hòa tan copper (II) hydroxide bằng glycerol
Hiện tượng:
- Sau khi nhỏ vào ống nghiệm 3 – 4 giọt dung dịch copper(II) sulfate 5% và 1 mL dung dịch sodium hydroxide 20%, lắc nhẹ thấy có kết tủa xanh xuất hiện.
- Tiếp tục nhỏ vào ống nghiệm thứ nhất 3 – 4 giọt ethanol, lắc nhẹ không thấy có hiện tượng gì xuất hiện.
- Tiếp tục nhỏ vào ống nghiệm thứ hai 3 – 4 giọt glycerol, lắc nhẹ không có hiện tượng gì xuất hiện
- Tiếp tục nhỏ vào ống nghiệm thứ hai 3 – 4 giọt glycerol, lắc nhẹ thấy kết tủa tan dần, thu được dung dịch có màu xanh lam đặc trưng
Giải thích hiện tượng bằng phương trình hóa học:
CuSO4(aq) + 2NaOH(aq) → Cu(OH)2(s) + Na2SO4(aq)
C2H5OH + Cu(OH)2 → không phản ứng

Các polyalcohol có hai nhóm hydroxy liền kề như ethylene glycol cũng có phản ứng hòa tan copper(II) hydroxide tương tự như glycerol.
IV. ỨNG DỤNG VÀ ĐIỀU CHẾ
1. Ứng dụng
- Ethanol: Dùng làm nhiên liệu cho đèn cồn trong các phòng thí nghiệm, được pha vào xăng, nguyên liệu tổng hợp các chất hữu cơ, chất khử trùng trong y tế, trong đồ uống có cồn.
- Methanol: Dùng để sản xuất formaldehyde và acetic acid.
- Glycerol: Chất giữ ẩm, chất chống lão hóa trong mĩ phẩm, hương vị trong thực phẩm, chất làm ngọt có năng lượng thấp, chất chống đông trong động cơ ô tô ở những nơi có nhiệt độ khí quyển thấp.
2. Điều chế
a) Điều chế ethanol
Phương pháp lên men:

Phương pháp hydrate hóa ethylene:
C2H4 + H2O $\overset{t^{o},xt}{\rightarrow}$ C2H5OH
b) Điều chế glycerol
Glycerol được tổng hợp từ propene theo sơ đồ:

Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
Giải bài tập những môn khác
Giải sgk lớp 11 KNTT
Giải sgk lớp 11 CTST
Giải sgk lớp 11 cánh diều
Giải SBT lớp 11 kết nối tri thức
Giải SBT lớp 11 chân trời sáng tạo
Giải SBT lớp 11 cánh diều
Giải chuyên đề học tập lớp 11 kết nối tri thức
Giải chuyên đề toán 11 kết nối tri thức
Giải chuyên đề ngữ văn 11 kết nối tri thức
Giải chuyên đề vật lí 11 kết nối tri thức
Giải chuyên đề hóa học 11 kết nối tri thức
Giải chuyên đề sinh học 11 kết nối tri thức
Giải chuyên đề kinh tế pháp luật 11 kết nối tri thức
Giải chuyên đề lịch sử 11 kết nối tri thức
Giải chuyên đề địa lí 11 kết nối tri thức
Giải chuyên đề mĩ thuật 11 kết nối tri thức
Giải chuyên đề âm nhạc 11 kết nối tri thức
Giải chuyên đề công nghệ chăn nuôi 11 kết nối tri thức
Giải chuyên đề công nghệ cơ khí 11 kết nối tri thức
Giải chuyên đề tin học 11 định hướng Khoa học máy tính kết nối tri thức
Giải chuyên đề tin học 11 định hướng Tin học ứng dụng kết nối tri thức
Giải chuyên đề quốc phòng an ninh 11 kết nối tri thức
Giải chuyên đề hoạt động trải nghiệm hướng nghiệp 11 kết nối tri thức
Giải chuyên đề học tập lớp 11 chân trời sáng tạo
Giải chuyên đề học tập lớp 11 cánh diều
Trắc nghiệm 11 Kết nối tri thức
Trắc nghiệm 11 Chân trời sáng tạo
Trắc nghiệm 11 Cánh diều
Bộ đề thi, đề kiểm tra lớp 11 kết nối tri thức
Đề thi Toán 11 Kết nối tri thức
Đề thi ngữ văn 11 Kết nối tri thức
Đề thi vật lí 11 Kết nối tri thức
Đề thi sinh học 11 Kết nối tri thức
Đề thi hóa học 11 Kết nối tri thức
Đề thi lịch sử 11 Kết nối tri thức
Đề thi địa lí 11 Kết nối tri thức
Đề thi kinh tế pháp luật 11 Kết nối tri thức
Đề thi công nghệ cơ khí 11 Kết nối tri thức
Đề thi công nghệ chăn nuôi 11 Kết nối tri thức
Đề thi tin học ứng dụng 11 Kết nối tri thức
Đề thi khoa học máy tính 11 Kết nối tri thức
Bộ đề thi, đề kiểm tra lớp 11 chân trời sáng tạo
Bộ đề thi, đề kiểm tra lớp 11 cánh diều
Đề thi Toán 11 Cánh diều
Đề thi ngữ văn 11 Cánh diều
Đề thi vật lí 11 Cánh diều
Đề thi sinh học 11 Cánh diều
Đề thi hóa học 11 Cánh diều
Đề thi lịch sử 11 Cánh diều
Đề thi địa lí 11 Cánh diều
Đề thi kinh tế pháp luật 11 Cánh diều
Đề thi công nghệ cơ khí 11 Cánh diều
Đề thi công nghệ chăn nuôi 11 Cánh diều
Đề thi tin học ứng dụng 11 Cánh diều
Đề thi khoa học máy tính 11 Cánh diều

Bình luận