Lý thuyết trọng tâm hóa học 10 kết nối bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Tổng hợp kiến thức trọng tâm hóa học 10 kết nối tri thức bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học. Tài liệu nhằm củng cố, ôn tập lại nội dung kiến thức bài học cho học sinh dễ nhớ, dễ ôn luyện. Kéo xuống để tham khảo
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
I. ĐỊNH LUẬT TUẦN HOÀN
Tính chất của các nguyên tố và đơn chất cũng như thành phần tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Trả lời câu 1 sgk trang 43:
Li | Be | B | … | O | F |
Kim loại mạnh | Kim loại yếu | Á kim | … | Phi kim mạnh | Phi kim rất mạnh |
Na | Mg | Al | … | S | Cl |
Kim loại điển hình | Kim loại mạnh | Kim loại hoạt động | … | Phi kim trung bình | Phi kim mạnh |
=> Tính kim loại giảm dần, tính phi kim tăng dần theo chiều tăng của điện tích hạt nhân và có xu hướng tuần hoàn.
II. Ý NGHĨA CỦA BẢNG TUẦN HOÀN
Sơ đồ mối quan hệ của các yếu tố:
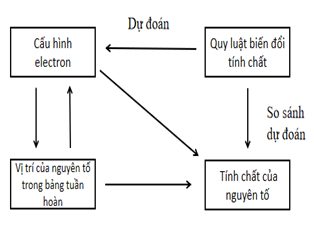
Ý nghĩa của bảng tuần hoàn: Vị trí của nguyên tố trong bảng tuần hoàn các nguyên tố hóa học cho biết cấu hình electron, cấu hình electron nguyên tử quyết định tính chất của các nguyên tố. Vì vậy có thể dự đoán được tính chất hóa học của các nguyên tố khi biết vị trí của nó trong bảng tuần hoàn các nguyên tố hóa học hay cấu hình electron của nó nhờ vào định luật tuần hoàn.
Ví dụ minh họa:
VD1: Nguyên tố sunlfu (S) ở ô số 16, nhóm VIA, chu kì 3.
=> Nguyên tử S có:
- 16 proton, 16 electron.
- 3 lớp electron.
- 6 electron lớp ngoài cùng.
Vậy cấu hình electron của S là: 1s22s22p63s23p4.
VD2: Cấu hình electron của nguyên tử phosphorus (P) là 1s22s22p63s23p3.
=> P có: Z =15, P ở ô số 15, chu kì 3, nhóm VA.
VD3: So sánh tính phi kim của P ( Z = 15) với N ( Z= 7) và S ( Z = 16)
Nguyên tố P và N cùng nhóm nên N có tính phi kim mạnh hơn P, P và S cùng chu kì nên P có tính phi kim yếu hơn S.
VD4: Nguyên tố có Z= 87, ta có thể dự đoán:
- Vị trí trong bảng tuần hoàn: Kết thúc chu kì 6 là nguyên tố số 86 nên nguyên tố này thuộc thu kì 7 - nhóm IA.
- Cấu hình electron: có 87 proton và 87 electron và lớp electron ngoài cùng là lớp thứ 7 có 1 electron: [86Rn] 7s1.
- Tính chất: ở nhóm IA nên tính chất hóa học của nó là kim loại kiềm và có tính kim loại mạnh nhất vì nằm ở cuối nhóm.
Trả lời câu hỏi 2 sgk trang 44:
a) Cấu hình electon của 12Mg: 1s22s22p63s2, là kim loại mạnh
Oxide: MgO là basic oxide trung bình, hydroxit Mg(OH)2 là base trung bình
b) Tính kim loại của 11Na > Mg> 13Al và 4Be < Mg < 20Ca.
Trả lời câu hỏi 3 sgk trang 44:
a) Cấu hình electron là 1s22s22p63s23p64s1
=> K ở ô số 19, chu kì 4, nhóm IA.
b) Đơn chất potassium là kim loại kiềm (nhóm IA) là kim loại mạnh hơn Na và Ca, nhưng yếu hơn Rb. Oxide K2O là basic oxide phản ứng với nước tạo ra hydroxide KOH là base mạnh.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây

Bình luận