Slide bài giảng Hóa học 12 Cánh diều bài 12: Điện phân
Slide điện tử bài 12: Điện phân. Trình bày với các hiệu ứng hiện đại, hấp dẫn. Giúp học sinh hứng thú học bài. Học nhanh, nhớ lâu. Có tài liệu này, hiệu quả học tập của môn Hóa học 12 Cánh diều sẽ khác biệt
Bạn chưa đủ điều kiện để xem được slide bài này. => Xem slide bài mẫu
Tóm lược nội dung
BÀI 12: ĐIỆN PHÂN
MỞ ĐẦU
Hình 12.1 mô tả sự chuyển động của các ion về các điện cực trong bình điện phân.
- Giải thích sự chuyển động của các ion về các điện cực.
- Dự đoán quá trình oxi hóa, quá trình khử xảy ra ở điện cực nào.
Trả lời rút gọn:
- Trong bình điện phân, các ion sẽ di chuyển về các cực trái dấu.
- Quá trình oxi hóa xảy ra ở điện cực dương, còn quá trình khử xảy ra ở điện cực âm.
I. KHÁI NIỆM VÀ THỨ TỰ ĐIỆN PHÂN
Câu hỏi 1: Vì sao phải điện phân NaCl ở trạng thái nóng chảy để điều chế Na? Có thể điện phân NaCl rắn được không?
Trả lời rút gọn:
Do ở dạng lỏng, NaCl là dung dịch chất điện li do có thể phân li ra các ion Na+ và Cl-, còn NaCl ở dạng rắn không phải chất điện li nên không thể điện phân được.
Luyện tập 1: Hãy viết phương trình hóa học của phản ứng điện phân xảy ra khi điện phân dung dịch CuCl2 bằng điện cực trơ (than chì).
Trả lời rút gọn:
Phương trình phản ứng:
![]()
Thí nghiệm 1: Điện phân dung dịch sodium chloride không màng ngăn để điều chế nước Javel.
Chuẩn bị:
- Hóa chất: Dung dịch NaCl bão hòa.
- Dụng cụ: Cốc thủy tinh loại 100 mL, hai điện cực than chì, nguồn điện một chiều 6V (hoặc pin 6V), dây dẫn điện.
Tiến hành: Nhúng hai điện cực vào cốc đựng khoảng 60 mL dung dịch NaCl bão hòa, rồi nối hai cực với nguồn điện bằng dây dẫn điện để tiến hành điện phân. Thời gian tiến hành điện phân tối thiểu là 5 phút.
Yêu cầu: Quan sát và mô tả hiện tượng xảy ra.
Chú ý: Không để hai điện cực đã nối nguồn điện chạm vào; đeo khẩu trang và thực hiện thí nghiệm ở nơi thoáng khí hoặc trong tủ hút.
Trả lời rút gọn:
Sau 5 phút, ta thấy ở cực dương của nguồn điện có xuất hiện khí trắng là Cl2, sau đó Cl2 phản ứng với dung dịch NaOH vừa tạo ra do không có màng ngăn ở giữa để chắn.
Thí nghiệm 2: Điện phân dung dịch copper(II) sulfate.
Chuẩn bị:
- Hóa chất: Dung dịch CuSO4 0,5 M.
- Dụng cụ: Cốc thủy tinh loại 100 mL, hai điện cực than chì, nguồn điện một chiều 6 V (hoặc pin 6V), dây dẫn điện.
Tiến hành: Nhúng hai điện cực vào cốc đựng khoảng 60 mL dung dịch CuSO4 0,5 M rồi nối hai điện cực với nguồn điện để tiến hành điện phân. Thời gian tiến hành điện phân tối thiểu là 5 phút.
Yêu cầu: Quan sát và mô tả hiện tượng xảy ra.
Chú ý: Không để hai điện cực đã nối nguồn điện chạm vào nhau.
Trả lời rút gọn:
Dung dịch mất dần màu xanh do CuSO4 đã bị điện li, tại cực âm xuất hiện chất rắn màu vàng nâu bám vào trong khi ở cực dương xuất hiện bọt khí.
Câu hỏi 2: Đối với quá trình điện phân dung dịch NaCl bão hòa không có màng ngăn:
- Hãy viết các quá trình oxi hóa và quá trình khử tại mỗi điện cực. Viết phương trình hóa học của quá trình điện phân.
- Vì sao sản phẩm thu được trong Thí nghiệm 1 là nước Javel (chứa NaOCl) mà không phải là NaOH? Giải thích.
Trả lời rút gọn:
- Quá trình oxi hóa tại điện cực âm:
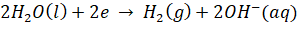
Quá trình khử tại điện cực dương: ![]()
- Khi không có màng ngăn, khí Cl2 được tạo thành qua quá trình điện phân sẽ tiếp tục phản ứng với dung dịch NaOH vừa được tạo thành để trở thành nước Javel.
![]()
Vận dụng 1: Tìm hiểu ứng dụng của Javel. Đề xuất thí nghiệm đơn giản để chứng minh rằng dung dịch nước Javel có tính tẩy màu.
Trả lời rút gọn:
Nước Javel có tác dụng:
- Tẩy trắng quần áo, vải vóc, sàn hoặc tường nhà...
- Khử trùng, khử mùi đồ gia dụng.
- Xử lý ô nhiễm nước.
- Khử trùng bồn cầu.
Thí nghiệm với dung dịch CuSO4 có thể kiểm chứng tính tẩy màu của nước Javel, bằng chứng là dung dịch thu được mất dần màu xanh và có xuất hiện kết tủa.
Câu hỏi 3: Cho biết trong Thí nghiệm 2, tại điện cực dương, H2O điện phân trước ion SO42- theo quá trình sau:
![]()
Xác định các sản phẩm thu được trong Thí nghiệm 2. Viết phương trình hóa học của quá trình điện phân.
Trả lời rút gọn:
Sản phẩm thu được bao gồm: Cu, H2SO4 và O2.
Phương trình hóa học:
![]()
Luyện tập 2: Hãy sắp xếp thứ tự điện phân các ion dương ở cực âm khi tiến hành điện phân dung dịch gồm: FeCl2 1 M, CuCl2 1 M và HCl 1 M.
Trả lời rút gọn:
Thứ tự điện phân các ion dương ở cực âm: Cu2+, H+, Fe2+.
II. ỨNG DỤNG CỦA ĐIỆN PHÂN TRONG THỰC TIỄN
Vận dụng 2: Hãy tìm hiểu và cho biết vì sao không điện phân nóng chảy AlCl3 trong sản xuất nhôm.
Trả lời rút gọn:
Khi điện phân nóng chảy AlCl3, ta sẽ thu được khí Cl2 và Al. Tuy nhiên, trong điều kiện có nhiệt độ cao, hai chất này sẽ lại phản ứng với nhau, do đó phương pháp điện phân này không được sử dụng trong sản xuất nhôm.
Vận dụng 3: Trong sản xuất nhôm bằng phương pháp điện phân, điện cực than chì được sử dụng ở cả cực dương và cực âm. Người ta nhận thấy, trong quá trình điện phân, điện cực dương bị hao mòn nhanh hơn điện cực âm. Hãy tìm hiểu và giải thích hiện tượng trên.
Trả lời rút gọn:
Khi quá trình điện phân xảy ra, tại điện cực dương xuất hiện khí O2 được sinh ra sau phản ứng. Tuy nhiên khí này đã phản ứng với than chì có ở trong điện cực ở nhiệt độ cao, do đó mà điện cực dương bị hao mòn nhanh hơn.
Vận dụng 4: Tìm hiểu trong thực tế và chỉ ra những ví dụ về việc sử dụng mạ điện với mục đích bảo vệ, mạ điện với mục đích trang trí.
Trả lời rút gọn:
Công dụng của mạ điện trong:
- Thực tế: giảm lực ma sát, bảo vệ khỏi sự bức xạ, tăng độ dẫn điện và dẫn nhiệt của kim loại, tăng độ bền...
- Trang trí: nâng cao tính thẩm mỹ khi mạ bạc, mạ vàng trang sức…
BÀI TẬP
Bài 1: Chọn những phát biểu đúng:
- Phản ứng xảy ra trong pin điện hóa là tự diễn biến, trong bình điện phân là không tự diễn biến.
- Phản ứng xảy ra trong pin điện hóa là không tự diễn biến, trong bình điện phân là tự diễn biến.
- Cực dương của bình điện phân được gọi là anode, của pin điện hóa được gọi là cathode.
- Cực dương của bình điện phân được gọi là cathode, của pin điện hóa được gọi là anode.
Trả lời rút gọn:
Những phát biểu đúng: (a), (c).
Bài 2: Xét quá trình sản xuất nhôm được thực hiện theo phương pháp điện phân Al2O3 nóng chảy với điện cực than chì.
- Giải thích vì sao thực tế thành phần thể tích khí bay ra ở cực dương gồm CO (30% – 50%) và CO2 (70% – 50%) mà không phải là O2.
- Trung bình để sản xuất được 1 tấn Al thì lượng điện cực than chì bị tiêu hao do phản ứng oxi hóa là bao nhiêu? Giả thiết thành phần khí bay ra ở cực dương gồm 50% CO và 50% CO2 về thể tích.
Trả lời rút gọn:
- Do quá trình điện phân sẽ sản sinh ra khí O2 ở cực dương, khi ấy khí O2 sẽ phản ứng hết với than chì để tạo ra khí CO và CO2.
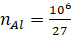 (mol)
(mol)
Ta có phương trình điện phân:
![]()
![]() (mol)
(mol)
Do %CO = %CO2 = 50% => ![]()
Gọi số mol của CO và CO2 là x, ta có:
![]() (mol)
(mol)
=> ![]() (mol)
(mol)
Số mol than chì tiêu hao là:
![]() (mol)
(mol)
=> ![]() (tấn).
(tấn).
