Slide bài giảng Hóa học 12 Cánh diều bài 10: Thế điện cực chuẩn của kim loại
Slide điện tử bài 10: Thế điện cực chuẩn của kim loại. Trình bày với các hiệu ứng hiện đại, hấp dẫn. Giúp học sinh hứng thú học bài. Học nhanh, nhớ lâu. Có tài liệu này, hiệu quả học tập của môn Hóa học 12 Cánh diều sẽ khác biệt
Bạn chưa đủ điều kiện để xem được slide bài này. => Xem slide bài mẫu
Tóm lược nội dung
BÀI 10: THẾ ĐIỆN CỰC CHUẨN CỦA KIM LOẠI
MỞ ĐẦU
Cho hai kim loại X và Y cùng hai cation tương ứng là Xm+ và Yn+. Xét phản ứng hóa học:
![]()
- Phản ứng hóa học trên thuộc loại phản ứng nào?
- Có thể dự đoán chiều của phản ứng hóa học trên dựa vào cơ sở nào?
Trả lời rút gọn:
- Phản ứng hóa học trên thuộc loại phản ứng oxi hóa – khử.
- Có thể dựa vào thế điện cực chuẩn của các chất để dự đoán chiều của phản ứng.
I. CẶP OXI HÓA – KHỬ CỦA KIM LOẠI
Câu hỏi 1: Cho hai phản ứng sau:
![]()
![]()
Hãy xác định chất oxi hóa, chất khử trong mỗi phản ứng trên.
Trả lời rút gọn:
Ở phản ứng (1): Chất oxi hóa là Cu2+, chất khử là Zn.
Ở phản ứng (2): Chất oxi hóa là Ag+, chất khử là Cu.
Luyện tập 1: Viết các cặp oxi hóa – khử của các kim loại trong hai phản ứng (1) và (2) ở trên.
Trả lời rút gọn:
Ở phản ứng (1), cặp oxi hóa – khử gồm: Zn2+/Zn và Cu2+/Cu.
Ở phản ứng (2), cặp oxi hóa – khử gồm: Cu2+/Cu và Ag+/Ag.
Luyện tập 2: Hãy viết cặp oxi hóa – khử của các kim loại trong dãy sau:

Trả lời rút gọn:
Những cặp oxi hóa – khử của kim loại theo dãy bao gồm: Mg2+/Mg, Al3+/Al, Zn2+/Zn, Fe3+/Fe, Fe2+/Fe, Fe3+/Fe2+, Sn2+/Sn, Pb2+/Pb, H+/H, Cu2+/Cu, Ag+/Ag và Au3+/Au.
II. THẾ ĐIỆN CỰC CHUẨN CỦA KIM LOẠI
Câu hỏi 2: So sánh thế điện cực chuẩn của cặp oxi hóa – khử Fe2+/Fe và Pb2+/Pb. Từ đó, so sánh tính oxi hóa của Fe2+ và Pb2+, tính khử của Fe và Pb.
Trả lời rút gọn:
Thế điện cực chuẩn của: ![]() ;
; ![]()
Vì ![]() => Tính oxi hóa của
=> Tính oxi hóa của ![]() ; tính khử của
; tính khử của ![]() .
.
Luyện tập 3: Hãy sắp xếp các ion sau theo chiều tăng dần tính oxi hóa: Na+, Zn2+, Au3+, Ni2+, H+.
Trả lời rút gọn:
Chiều tăng dần oxi hóa của các ion: Na+, Zn2+, Ni2+, H+, Au3+.
Câu hỏi 3: Phản ứng nào sau đây có thể xảy ra ở điều kiện chuẩn? Giải thích.
Trả lời rút gọn:
- Phản ứng này có xảy ra do tính oxi hóa của
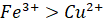 và tính khử của
và tính khử của 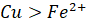 (vì
(vì 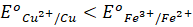 ).
). - Phản ứng này không xảy ra do tính oxi hóa của
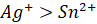 mà tính khử của
mà tính khử của 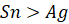 (vì
(vì 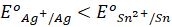 ).
).
BÀI TẬP
Bài 1: Kim loại M tan được trong dung dịch HCl 1 M ở 25oC tạo muối MCln và H2. Hãy so sánh giá trị thế điện cực chuẩn của cặp Mn+/M và 2H+/H2. Giải thích.
Trả lời rút gọn:
Do phản ứng trên xảy ra chứng tỏ tính oxi hóa của ![]() và tính khử của
và tính khử của ![]() , vậy nên
, vậy nên ![]() .
.
Bài 2: Cho các cặp oxi hóa – khử sau:
- Mg2+/Mg và Cu2+/Cu.
- Zn2+/Zn và Fe2+/Fe.
- Ag+/Ag và Au3+/Au.
Viết các phương trình hóa học của phản ứng theo chiều tự diễn biến từ các cặp oxi hóa – khử tương ứng đã cho.
Trả lời rút gọn:
Phương trình hóa học tương ứng:
 .
. .
. .
.
Bài 3: Thế điện cực chuẩn của cặp M+/M (M là kim loại) bằng –3,040 V. Những phát biểu liên quan đến cặp oxi hóa – khử M+/M nào dưới đây là đúng?
|
|
|
|
Trả lời rút gọn:
- Đúng.
- Đúng.
- Sai. Do
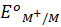 rất nhỏ nên M có tính khử mạnh.
rất nhỏ nên M có tính khử mạnh. - Sai. Do
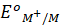 rất nhỏ nên ion M có tính oxi hóa yếu.
rất nhỏ nên ion M có tính oxi hóa yếu.
Bài 4: Chromium (Cr) thường được sử dụng để mạ lên kim loại do Cr tạo được lớp phủ sáng bóng. Hãy cho biết thiết bị kim loại được mạ Cr có bền trong môi trường là dung dịch Fe(NO3)2 không. Giải thích.
Cho biết thế điện cực chuẩn của cặp Cr2+/Cr là –0,910 V.
Trả lời rút gọn:
Do ![]() (dựa vào Bảng 10.1) nên tính khử của
(dựa vào Bảng 10.1) nên tính khử của ![]() và tính oxi hóa của
và tính oxi hóa của ![]() .
.
Do phản ứng oxi hóa – khử xảy ra nên thiết bị kim loại được mạ Cr thường không bên trong môi trường là dung dịch Fe(NO3)2.
