Soạn giáo án điện tử hóa học 11 Cánh diều Bài 2: Sự điện li trong dung dịch nước. Thuyết Brønsted – Lowry về acid – base
Giáo án powerpoint hóa học 11 Cánh diều mới. Giáo án soạn theo tiêu chí hiện đại, đẹp mắt với nhiều hình ảnh, nội dung, hoạt động phong phú, sáng tạo. Giáo án điện tử này dùng để giảng dạy online hoặc trình chiếu. Tin rằng, bộ bài giảng này sẽ hỗ trợ tốt việc giảng dạy và đem đến sự hài lòng với thầy cô.
Xem hình ảnh về giáo án











Còn nữa....Giáo án khi tải về là bản đầy đủ. Có full siles bài giảng!
Nội dung giáo án
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC MỚI
KHỞI ĐỘNG
Quan sát Hình 2.1, em hãy nêu những sự khác nhau giữa chất điện li và chất không điện li.
BÀI 2. SỰ ĐIỆN LI TRONG DUNG DỊCH NƯỚC. THUYẾT BRONSTED – LOWRY VỀ THUYẾT ACID – BASE
NỘI DUNG BÀI HỌC
Sự điện li, chất điện li và chất không điện li
Thuyết Bronsted – Lowry về acid – base
- SỰ ĐIỆN LI, CHẤT ĐIỆN LI VÀ CHẤT KHÔNG ĐIỆN LI
Trong đời sống thường ngày có rất nhiều quá trình hòa tan các chất vào nước, chẳng hạn hòa tan muối ăn vào nước hay hòa tan đường kính vào nước. Có sự khác biệt cơ bản nào xảy ra khi muối ăn và đường tan trong nước?
HOẠT ĐỘNG NHÓM
- Mô tả lại hiện tượng quan sát được trong Hình 2.2 (SGK tr.15).
- Nhận xét sự khác nhau về hiện tượng bóng đèn sáng và không sáng ở cốc nước muối và cốc nước đường. Giải thích sự khác nhau đó.
Cốc đựng nước muối, bóng đèn sáng
Cốc đựng nước đường, bóng đèn không sáng
Nước muối dẫn điện chứng tỏ trong dung dịch có chứa các hạt mang điện chuyển động tự do ® Các ion
Câu hỏi 1 (SGK tr.16): Trong thí nghiệm trên, bóng đèn sáng hay không sáng chứng tỏ tính chất vật lí nào của dung dịch chất tan
Trong thí nghiệm, đèn sáng hay không sáng chứng tỏ tính dẫn điện của dung dịch chất tan
- Đèn sáng chứng tỏ dung dịch chất tan dẫn điện
- Đèn không sáng chứng tỏ dung dịch chất tan không dẫn điện
Kết luận
- Quá trình phân li của các chất khi tan trong nước thành các ion được gọi là sự điện li.
- Chất điện li là chất khi tan trong nước phân li thành các ion. Chất không điện li là chất khi tan trong nước không phân li thành các ion.
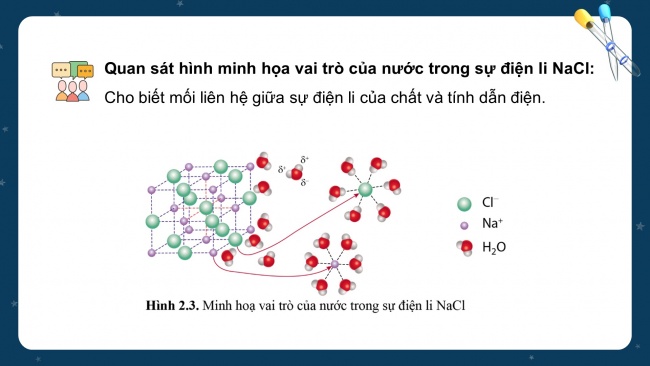
Quan sát hình minh họa vai trò của nước trong sự điện li NaCl: Cho biết mối liên hệ giữa sự điện li của chất và tính dẫn điện.
- Nước đóng vai trò quan trọng trong sự điện li của một chất nhờ tính chất phân cực của phân tử nước. Khi hòa tan một chất điện li vào nước, xuất hiện tương tác của nước với các ion, tương tác này sẽ bứt các ion khỏi tinh thể để tan vào nước.
- Dung dịch chất điện li mạnh dẫn điện tốt hơn chất điện li yếu do chất điện li mạnh tạo nhiều ion hơn.
- THUYẾT BRONSTED – LOWRY VỀ ACID – BASE
Thuyết Bronsted – Lowry về acid - base
Nội dung: Acid là những chất có khả năng cho H+, base là những chất có khả năng nhận H+.
Hoạt động nhóm. Tìm hiểu các ví dụ 1 – 3 (SGK tr.17)
Dựa vào Ví dụ 1, trả lời Câu hỏi 2 (SGK tr17): Ở quá trình (3b), nước đóng vai trò là acid hay base? Vì sao?
Dựa vào Ví dụ 2, 3, trả lời Câu hỏi 3 (SGK tr17): Dựa vào cân bằng (4) và (5), hãy giải thích vì sao H2O được coi là chất lưỡng tính (chất vừa có tính acid, vừa có tính base).
Trả lời câu 2:
Quá trình (3b):
HCl + H2O → H3O+ + Cl-
Trong quá trình này nước đóng vai trò là base do nhận H+:
H2O + H+ → H3O+
Trả lời câu 3:
Nước được cho là chất có tính lưỡng tính (vừa có tính acid, vừa có tính base) do:
Vừa có khả năng nhường H+ (cân bằng 4)
Vừa có khả năng nhận H+ (cân bằng 5)
Acid/base mạnh và acid/base yếu
Theo thuyết Bronsted – Lowry, HCl và CH3COOH đều là acid. Tuy nhiên, có sự khác nhau khi viết phương trình điện li:
HCl H+ + Cl-
Mũi tên một chiều cho biết đây là quá trình một chiều và HCl phân li hoàn toàn trong nước
CH3COOH CH3COO- + H+
Mũi tên thuận nghịch cho biết đây là quá trình thuận nghịch và CH3COOH không phân li hoàn toàn trong nước
Kết luận
Acid và base mạnh phân li hoàn toàn trong nước. Acid yếu và base yếu phân li một phần trong nước.
Ví dụ
100 phân tử HCl (trong nước) ở một điều kiện nào đó: Cả 100 phân tử phân li hết thành H+ và Cl-
100 phân tử CH3COOH ở cùng điều kiện: Chỉ có 2 phân tử phân li thành CH3COO- trong nước.
Hoạt động nhóm
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
