Soạn giáo án điện tử hóa học 11 Cánh diều Bài 1: Mở đầu về cân bằng hoá học
Giáo án powerpoint hóa học 11 Cánh diều mới. Giáo án soạn theo tiêu chí hiện đại, đẹp mắt với nhiều hình ảnh, nội dung, hoạt động phong phú, sáng tạo. Giáo án điện tử này dùng để giảng dạy online hoặc trình chiếu. Tin rằng, bộ bài giảng này sẽ hỗ trợ tốt việc giảng dạy và đem đến sự hài lòng với thầy cô.
Xem hình ảnh về giáo án









Còn nữa....Giáo án khi tải về là bản đầy đủ. Có full siles bài giảng!
Nội dung giáo án
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC MỚI
KHỞI ĐỘNG
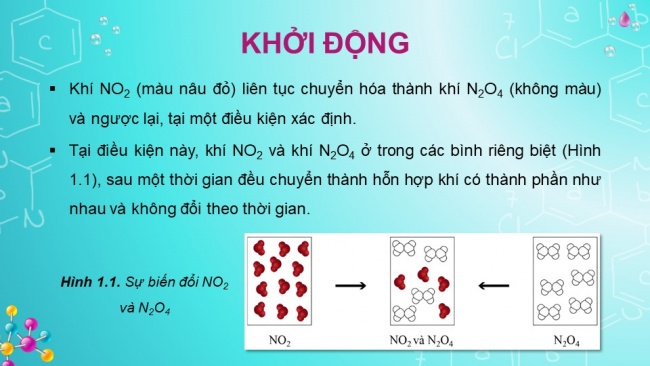
- Khí NO2 (màu nâu đỏ) liên tục chuyển hóa thành khí N2O4 (không màu) và ngược lại, tại một điều kiện xác định.
- Tại điều kiện này, khí NO2 và khí N2O4 ở trong các bình riêng biệt (Hình 1.1), sau một thời gian đều chuyển thành hỗn hợp khí có thành phần như nhau và không đổi theo thời gian.
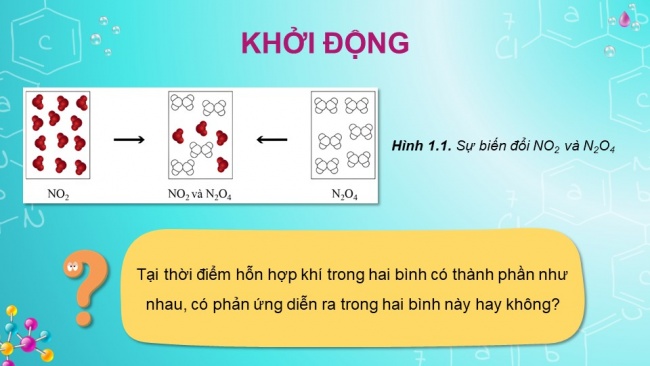
Hình 1.1. Sự biến đổi NO2 và N2O4
Tại thời điểm hỗn hợp khí trong hai bình có thành phần như nhau, có phản ứng diễn ra trong hai bình này hay không?
BÀI 1. MỞ ĐẦU VỀ CÂN BẰNG HOÁ HỌC
NỘI DUNG BÀI HỌC
Khái niệm phản ứng thuận nghịch và trạng thái cân bằng
Biểu thức hằng số cân bằng và ý nghĩa
Ảnh hưởng của nhiệt độ, nồng độ và áp suất đến cân bằng hoá học
- KHÁI NIỆM PHẢN ỨNG THUẬN NGHỊCH VÀ TRẠNG THÁI CÂN BẰNG
- Cho phương trình hóa học sau:
Fe(s) + 2HCl(aq) FeCl2(aq) + H2(g) (1)
Đặc điểm của phản ứng (1):
- Trong cùng điều kiện, FeCl2(aq) và H2(g) không thể biến đổi lại thành Fe(s) và HCl(aq) được.
- Phản ứng có đặc điểm như vậy được gọi là phản ứng một chiều.
Khái niệm
Phản ứng một chiều là phản ứng chỉ xảy ra theo chiều chất phản ứng biến đổi thành chất sản phẩm.
Ví dụ: Fe(s) + 2HCl(aq) FeCl2(aq) + H2(g)
Đặc điểm
Các chất sản phẩm không phản ứng lại được với nhau tạo thành chất ban đầu.
Vậy có phản ứng nào mà các chất sản phẩm phản ứng được với nhau để tạo thành chất ban đầu không?
Phản ứng thuận nghịch
HOẠT ĐỘNG CẶP ĐÔI: Tìm hiểu Ví dụ 1 (SGK tr.7) và trả lời câu hỏi
N2(g) + 3H2(g) 2NH3(g) (1)
Chiều các chất ban đầu tạo thành sản phẩm được gọi là chiều gì?
Chiều thuận
Chiều các chất sản phẩm tạo thành chất ban đầu được gọi là chiều gì?
Chiều nghịch
Phản ứng thuận nghịch là gì?
Khái niệm: Phản ứng thuận nghịch là phản ứng trong đó ở cùng điều kiện, xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng.
Bài tập
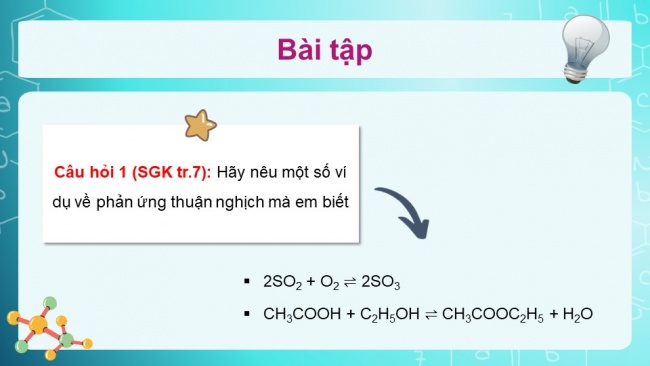
Câu hỏi 1 (SGK tr.7): Hãy nêu một số ví dụ về phản ứng thuận nghịch mà em biết
- 2SO2 + O2 2SO3
- CH3COOH + C2H5OH CH3COOC2H5 + H2O
Trạng thái cân bằng
HOẠT ĐỘNG NHÓM: Nghiên cứu về trạng thái cân bằng hóa học trong Ví dụ 2 (SGK tr.7, 8)
H2(g) + I2(g) 2HI (g)
Câu hỏi 2 (SGK tr.7). Xét Ví dụ 2:
- a) Giải thích vì sao màu tím của hỗn hợp khí lại nhạt dần so với lúc mới bắt đầu trộn hai khí H2 và I2 với nhau.
- b) Sau một khoảng thời gian, màu tím của hỗn hợp không thay đổi, chứng tỏ nồng độ của chất nào không thay đổi?
Câu hỏi 3 (SGK tr.7). Cho hai đồ thị (a) và (b) dưới đây. Mỗi đồ thị biểu diễn sự thay đổi tốc độ phản ứng thuận và tốc độ phản ứng nghịch theo thời gian:
Hãy cho biết đồ thị nào thể hiện đúng Ví dụ 2. Đường màu xanh trong đồ thị đó biểu diễn tốc độ phản ứng thuận hay tốc độ phản ứng nghịch?
H2(g) + I2(g) 2HI (g)
Câu hỏi 2. a) Sau khi trộn hai khí, phản ứng thuận diễn ra:
Nồng độ H2 và I2 giảm dần
giảm dần
Màu tím của hỗn hợp giảm dần
- b) Sau một khoảng thời gian, màu tím của hỗn hợp không thay đổi
® Nồng độ của I2 không thay đổi nữa
Câu hỏi 3.
Đồ thị (a) thể hiện đúng Ví dụ 2
Đường màu xanh trong đồ thị biểu diễn tốc độ phản ứng nghịch
Nhận xét
- Trong thí nghiệm:
- Lúc đầu: Phản ứng thuận có tốc độ lớn hơn phản ứng nghịch, ưu tiên tạo ra hydrogen iodine.
- Theo thời gian: Tốc độ phản ứng thuận giảm dần, tốc độ phản ứng nghịch tăng dần đến khi tốc độ hai phản ứng bằng nhau.
- Tại thời điểm này: Số mol của các chất hydrogen, iodine, hydrogen iodine không thay đổi nữa.
- Thời điểm phản ứng thuận nghịch đạt tới trạng thái cân bằng.
Khái niệm: Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái mà tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Cân bằng hóa học là một cân bằng động
Ở trạng thái cân bằng: Phản ứng thuận nghịch vẫn tiếp diễn với tốc độ bằng nhau
Ở trạng thái cân bằng: Nồng độ của một chất bất kì trong phản ứng không đổi
Bài tập
Câu hỏi 4 (SGK tr.8). Vì sao giá trị là một hằng số ở nhiệt độ xác định?
Lời giải:
- Ta có:
- Vì ở trạng thái cân bằng nồng độ của một chất bất kì trong phản ứng không đổi nên giá trị là một hằng số ở nhiệt độ xác định.
- BIỂU THỨC HẰNG SỐ CÂN BẰNG VÀ Ý NGHĨA
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
