Soạn giáo án điện tử hóa học 10 kết nối bài 9: Ôn tập chương II
Giáo án powerpoint hóa học 10 kết nối tri thức mới bài bài 9: Ôn tập chương II. Giáo án soạn theo tiêu chí hiện đại, đẹp mắt với nhiều hình ảnh, nội dung, hoạt động phong phú, sáng tạo. Giáo án điện tử này dùng để giảng dạy online hoặc trình chiếu. Tin rằng, bộ bài giảng này sẽ hỗ trợ tốt việc giảng dạy và đem đến sự hài lòng với thầy cô.










Còn nữa....Giáo án khi tải về là bản đầy đủ. Có full siles bài giảng!
Nội dung giáo án
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC MÔN HOÁ
Các nguyên tố được sắp xếp theo từng hàng, các hàng đó còn gọi là gì?
CHU KÌ
Trong một nhóm số electron của lớp vỏ ngoài cùng tăng dần, giảm dần hay bằng nhau?
BẰNG NHAU
Trong bảng tuần hoàn, các nguyên tố được sắp xếp như thế nào theo điện tích hạt nhân?
THEO CHIỀU TĂNG ĐIỆN TÍCH HẠT NHÂN
Số lớp electron tương ứng với vị trí chu kì hay nhóm?
CHU KÌ
Các nguyên tố nhóm A có bao nhiêu cột?
8 CỘT
BÀI 9. ÔN TẬP CHƯƠNG II
NỘI DUNG BÀI HỌC
HỆ THỐNG HOÁ KIẾN THỨC
LUYỆN TẬP
- HỆ THỐNG HOÁ KIẾN THỨC
Làm bài cá nhân, hoàn thành các câu hỏi 1, 2, 3, 4 phần 1
- Cấu tạo bảng tuần hoàn
- Ta có:
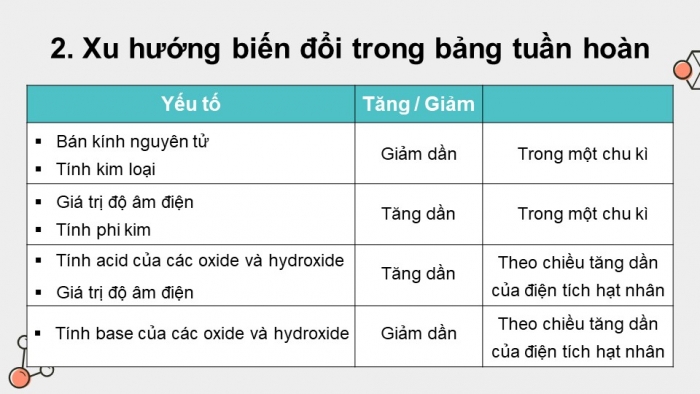
- Điện tích hạt nhân tăng dần
- Cùng số lớp electron → cùng chu kì (hàng)
- Cùng số electron hóa trị → cùng nhóm (cột)
- Trong bảng tuần hoàn hiện nay có 118 nguyên tố, 7 chu kì và 18 nhóm.
- Xu hướng biến đổi trong bảng tuần hoàn
- Bảng tuần hoàn và cấu tạo nguyên tử
(1) số proton = (2) số Z = (3) số electron = (4) số hiệu nguyên tử
(5) số lớp electron = (6) số thứ tự chu kì
(7) số electron lớp ngoài cùng = (8) số thứ tự nhóm A
- Định luật tuần hoàn
Tính chất của các nguyên tố cũng như thành phần và tính chất của các hợp chất cấu tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử. - LUYỆN TẬP
Nhóm 1: Trả lời CH1
Nhóm 2: Trả lời CH2
Nhóm 3: Trả lời CH3
Nhóm 4: Trả lời CH4
CH1 (SGK tr.46). Cho vị trí của các nguyên tố E, T, Q, X, Y trong bảng tuần hoàn rút gọn (chỉ biểu diễn các nguyên tố nhóm A) như sau:
Có các nhận xét sau:
(1) Thứ tự giảm dần tính kim loại là Y, E, X.
(2) Thứ tự tăng dần độ âm điện là Y, X, T.
(3) Thứ tự tăng dần tính phi kim là T, Q.
(4) Thứ tự giảm dần bán kính nguyên tử Y, E, X, T.
Số nhận xét đúng là
- 1 B. 2 C. 3 D. 4.
Giải thích:
- Y, E và X cùng chu kì: Trong một chu kì, tính kim loại giảm từ trái qua phải → (1) đúng.
- Độ âm điện Y(0,98), X(2,55), T(3,98) cùng chu kì → (2) đúng.
- T và Q cùng nhóm VIIA: Trong một nhóm A, tính phi kim giảm từ trên xuống dưới → tính phi kim T > Q → (3) sai.
- Y, E, X và T cùng chu kì: Trong một chu kì, bán kính nguyên tử giảm dần từ trái qua phải → (4) đúng.
- CH2 (SGK tr.47). Sulfur (S) là nguyên tố thuộc nhóm VIA, chu kì 3 của bảng tuần hoàn. Trong các phát biểu sau:
- (1) Nguyên tử S có 3 lớp electron và có 10 electron p.
- (2) Nguyên tử S có 5 electron hóa trị và 6 electron s.
- (3) Công thức oxide cao nhất của S có dạng là SO3và là acidic oxide.
- (4) Nguyên tố S có tính phi kim mạnh hơn so với nguyên tố có số hiệu nguyên tử là 8.
- (5) Hydroxide cao nhất của S có dạng H2SO4và có tính acid.
- Số phát biểu đúng là:
- 2. B. 3. C. 4. D. 5.
Giáo án điện tử hóa học 10 Kết nối, giáo án powerpoint hóa học 10 kết nối bài 9: Ôn tập chương II, bài giảng điện tử hóa học 10 kết nối
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
