Soạn giáo án điện tử hóa học 10 kết nối bài 12: Liên kết cộng hoá trị
Giáo án powerpoint hóa học 10 kết nối tri thức mới bài bài 12: Liên kết cộng hoá trị. Giáo án soạn theo tiêu chí hiện đại, đẹp mắt với nhiều hình ảnh, nội dung, hoạt động phong phú, sáng tạo. Giáo án điện tử này dùng để giảng dạy online hoặc trình chiếu. Tin rằng, bộ bài giảng này sẽ hỗ trợ tốt việc giảng dạy và đem đến sự hài lòng với thầy cô.










Còn nữa....Giáo án khi tải về là bản đầy đủ. Có full siles bài giảng!
Nội dung giáo án
CHÀO MỪNG CÁC EM ĐẾN VỚI BUỔI HỌC MÔN HOÁ
KHỞI ĐỘNG
Nguyên tử hydrogen và chlorine dễ dàng kết hợp để tạo thành phân tử hydrogen chloride (HCl), liên kết trong trường hợp này có gì khác so với liên kết ion trong phân tử sodium chloride (NaCl)?
BÀI 12. LIÊN KẾT CỘNG HOÁ TRỊ
NỘI DUNG BÀI HỌC
SỰ TẠO THÀNH LIÊN KẾT CỘNG HOÁ TRỊ
ĐỘ ÂM ĐIỆN VÀ LIÊN KẾT HOÁ HỌC
MÔ TẢ LIÊN KẾT CỘNG HOÁ TRỊ BẰNG SỰ XEN PHỦ CÁC ORBITAL NGUYÊN TỬ
NĂNG LƯỢNG LIÊN KẾT CỘNG HOÁ TRỊ
- SỰ HÌNH THÀNH LIÊN KẾT CỘNG HOÁ TRỊ
HOẠT ĐỘNG CẶP ĐÔI
Cho hai nguyên tử phi kim H và Cl:
- Viết cấu hình electron của 2 nguyên tố này.
- Xác định số electron hóa trị.
- Nêu xu hướng nhường nhận electron để tạo cấu hình bền.
Cho hai nguyên tử phi kim H và Cl:
- 2 nguyên tử này liên kết với nhau theo kiểu liên kết nào?
- Nhận xét về xu hướng tạo liên kết cộng hóa trị giữa 2 nguyên tử phi kim.
- H: 1s1
- Có 1e hóa trị → Nhận thêm 1e để có cấu hình bền
- Cl: 1s22s22p63s23p5
- Có 5e hóa trị → Nhận thêm 1e để có cấu hình bền
- Khi liên kết với nhau, H và Cl mỗi nguyên tử góp 1e tạo cặp electron dùng chung để thỏa mãn mỗi nguyên tử có 8e.
Nhận xét
Các nguyên tử phi kim hóa trị gần bão hòa có xu hướng nhận thêm electron.
- Khi 2 nguyên tử phi kim liên kết với nhau, chúng sẽ góp electron để dung chung.
- Các cặp electron dùng chung tạo ra liên kết cộng hóa trị giữa hai nguyên tử.
Liên kết cộng hoá trị chia làm 2 loại
- Liên kết cộng hoá trị A – B
- Liên kết cho nhận B → A
Hoạt động cặp đôi: Giải thích sự liên kết giữa hai nguyên tử Cl hoặc nguyên tử H và Cl thỏa mãn quy tắc octet.
Nêu số electron hóa trị của các nguyên tử?
Nêu xu hướng tạo cặp electron dùng chung?
Biểu diễn công thức lewis từ công thức electron bằng cách thay mỗi cặp electron dùng chung bằng một gạch nối.
- Sự tạo thành liên kết đơn
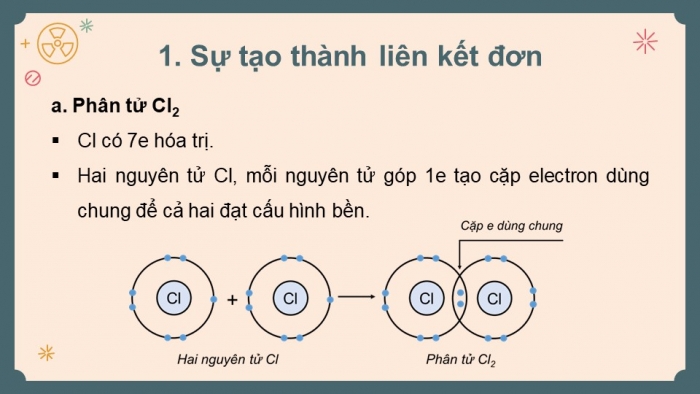
- Phân tử Cl2
- Cl có 7e hóa trị.
- Hai nguyên tử Cl, mỗi nguyên tử góp 1e tạo cặp electron dùng chung để cả hai đạt cấu hình bền.
- Phân tử Cl2
- Biểu diễn công thức lewis bằng sơ đồ:
- Phân tử HCl
- Cl có 7e hóa trị → Cl góp 1e
- H có 1e hóa trị → H góp 1e
- Biểu diễn công thức lewis bằng sơ đồ:
- Tạo cặp electron dùng chung để cả 2 đạt cấu hình bền.
- Phân tử hợp chất có liên kết cho nhận
- Trong phân tử NH3, lớp ngoài cùng của nguyên tử nitrogen có 5e, trong đó có cặp electron chưa liên kết.
- Ion H+ không có electron → Chỉ còn orbital trống.
- Để thỏa mãn quy tắc octet: Nguyên tử N góp 1 cặp electron để dùng chung với ion H+, tạo thành phân tử NH4+.
- Liên kết cho nhận được hình thành
- Hoạt động cặp đôi: Giải thích trong phân tử O2, CO2, N2, các nguyên tử liên kết với nhau như thế nào để thỏa mãn quy tắc octet.
Giáo án điện tử hóa học 10 Kết nối, giáo án powerpoint hóa học 10 kết nối bài 12: Liên kết cộng hoá trị, bài giảng điện tử hóa học 10 kết nối
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
