Soạn giáo án điện tử hóa học 10 kết nối bài 4: Ôn tập chương 1
Giáo án powerpoint hóa học 10 kết nối tri thức mới bài bài 4: Ôn tập chương 1. Giáo án soạn theo tiêu chí hiện đại, đẹp mắt với nhiều hình ảnh, nội dung, hoạt động phong phú, sáng tạo. Giáo án điện tử này dùng để giảng dạy online hoặc trình chiếu. Tin rằng, bộ bài giảng này sẽ hỗ trợ tốt việc giảng dạy và đem đến sự hài lòng với thầy cô.









Còn nữa....Giáo án khi tải về là bản đầy đủ. Có full siles bài giảng!
Nội dung giáo án
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC NGÀY HÔM NAY!
KHỞI ĐỘNG
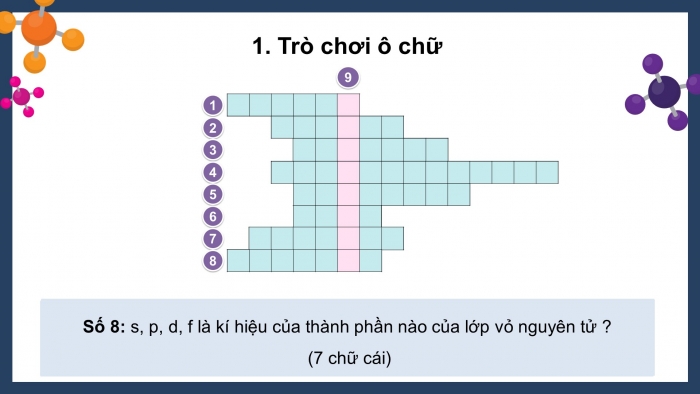
Trò chơi ô chữ
- Có 8 từ hàng ngang tương ứng với 8 câu hỏi gợi ý bất kỳ.
- Các em dựa vào gợi ý và tìm từ hàng ngang tương ứng với số ô chữ của mỗi hàng. Nếu trả lời đúng có cơ hội trả lời từ hàng dọc.
- Các em có thể lựa chọn thứ tự câu hỏi bất kì.
BÀI 4:
ÔN TẬP CHƯƠNG 1
- HỆ THỐNG HÓA KIẾN THỨC
THẢO LUẬN NHÓM
Hoàn thành sơ đồ hệ thống hóa kiến thức trong sgk trang 26 và trình bày vào bảng nhóm.
- LUYỆN TẬP
Câu 1: Số proton, neutron và electron của lần lượt là:
- 19, 20, 39.
- 20,19, 39.
- 19, 20, 19.
- 19,19, 20
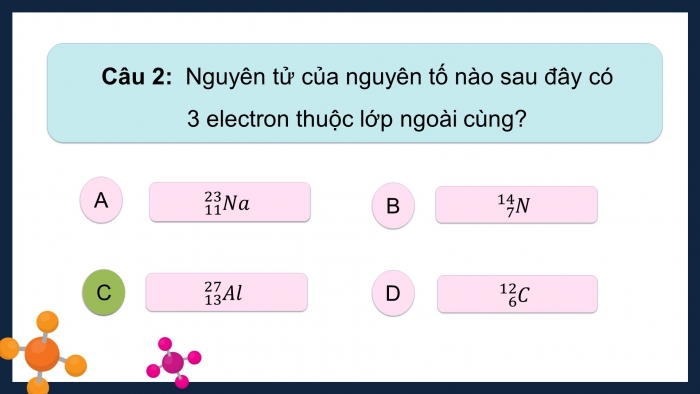
Câu 2: Nguyên tử của nguyên tố nào sau đây có 3 electron thuộc lớp ngoài cùng?
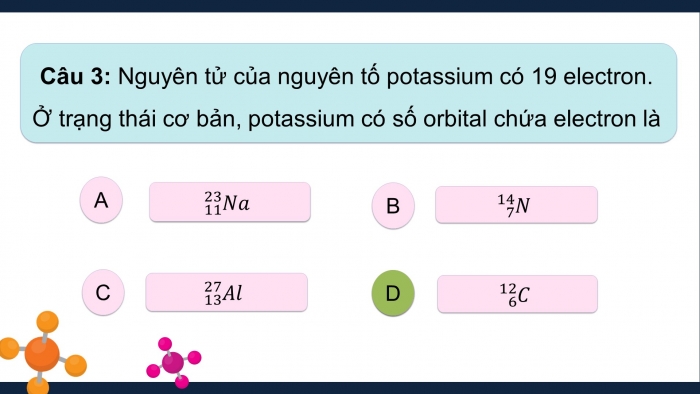
Câu 3: Nguyên tử của nguyên tố potassium có 19 electron. Ở trạng thái cơ bản, potassium có số orbital chứa electron là
Câu 4: Nguyên tử của nguyên tố sodium (natri) (Z=11) có cấu hình electron là
- 1s22s22p63s2
- 1s22s22p6
- 1s22s22p63s1
- 1s22s22p53s2
Câu 5: Tổng số hạt proton, neutron và electron trong nguyên tử X là 58. Số hạt mang điện nhiều hơn số hạt không mang điện là 18. X là
- Cl
- Ca
- K
- S
Đáp án
Tổng số hạt mang điện là 58, ta có:
p + n + e = 58 → 2p + n = 58 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 18, tức là:
p + e - n = 18 → 2p – n = 18 (2)
Từ (1) và (2), giải hệ 2 phương trình 2 ẩn ta được:
p = e = 19. X là K ( kali)
- VẬN DỤNG
Câu 6: Nguyên tố chlorine có Z= 17. Hãy cho biết số lớp electron, số electron thuộc lớp ngoài cùng, số electron độc thân của nguyên tử chlorine.
Đáp án
Nguyên tố chlorine có Z = 17, cấu hình electron: 1s22s22p63s23p5
- Số lớp electron: 3
- Số electron thuộc lớp ngoài cùng: 7
- Số electron độc thân: 1
Câu 7: Nguyên tử khối trung bình của vanadium (V) là 50,9975. Nguyên tố V có 2 đồng vị trong đó có đồng vị chiếm 0,25%. Tính số khối của đơn vị còn lại.
Đáp án
Gọi số khối của đồng vị còn lại là X, đồng vị này chiếm 99,75%.
Ta có phương trình: 50,94 = (50.0,25+X.99,75) :100
Giải phương trình có: X = 50,942.
Vậy số khối của đồng vị còn lại là 50,942.
Câu 8: Cấu hình electron của:
- Nguyên tử X: 1s22s22p63s23p64s1.
- Nguyên tử Y: 1s22s22p63s23p4.
a, Mỗi nguyên tử X và Y chứa bao nhiêu electron?
b, Hãy cho biết số hiệu nguyên tử của X và Y.
c, Hãy cho biết số hiệu nguyên tử X và Y có mức năng lượng cao nhất ?
d, Mỗi nguyên tử X và Y có bao nhiêu lớp electron, bao nhiêu phân lớp electron ?
e, X và Y là nguyên tố kim loại, phi kim hay khí hiếm?
Đáp án
- a) Nguyên tử X chứa: 2+8+8+1= 19 electron.
Nguyên tử Y: 16 electron.
- b) Số hiệu nguyên tử X: 19
Số hiệu nguyên tử Y: 16
- c) Phân lớp electron có mức năng lượng cao nhất:
X: 4s1 và Y: 3p4.
Giáo án điện tử hóa học 10 Kết nối, giáo án powerpoint hóa học 10 kết nối bài 4: Ôn tập chương 1, bài giảng điện tử hóa học 10 kết nối
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
