Lý thuyết trọng tâm hóa học 11 kết nối bài 5: Ammonia - Muối Ammonium
Tổng hợp kiến thức trọng tâm hóa học 11 kết nối bài 5: Ammonia - Muối Ammonium. Tài liệu nhằm củng cố, ôn tập lại nội dung kiến thức bài học cho học sinh dễ nhớ, dễ ôn luyện. Kéo xuống để tham khảo
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
I. AMMONIA
1. Cấu tạo phân tử
Đặc điểm cấu tạo của phân tử ammonia:
- Nguyên tử nitrogen còn một cặp electron không liên kết, tạo ra vùng có mật độ điện tích âm trên nguyên tử nitrogen
- Liên kết N – H phân cực, cặp electron dùng chung lệch về nguyên tử nitrogen làm cho nguyên tử hydrogen mang một phần điện tích dương
- Liên kết N – H tương đối bền với năng lượng liên kết là 386 kJ/mol
2. Tính chất vật lí
- Ở điều kiện thường, ammonia tồn tại ở thể khí, không màu, nhẹ hơn không khí, mùi khai và xốc
- Ammonia tan nhiều trong nước
- Ammonia dễ hóa lỏng và dễ hóa rắn.
Giữa các phân tử ammonia (chất tan) và phân tử nước (dung môi) có tương tác mạnh nên ammonia phân tán tốt vào nước, tức tan tốt trong nước. Hai tương tác cơ bản giữa các phân tử ammonia và nước là liên kết hydrogen và tương tác van der Waals (phân tử ammonia và nước đều phân cực mạnh)
3. Tính chất hóa học
a) Tính base
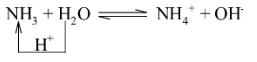
Dung dịch ammonia có môi trường base yếu, làm quỳ tím chuyển màu xanh, phenolphthalein chuyển màu hồng
Trong các phản ứng sau, NH$_{3}$ nhận proton (H$^{+}$) nên thể hiện là base; HCl, HNO$_{3}$ và H$_{2}$SO$_{4}$ nhường proton nên thể hiện là acid
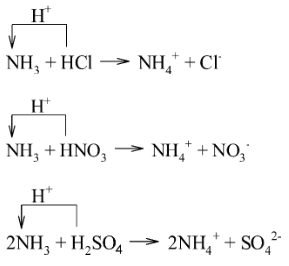
b) Tính khử
- $4NH_{3}+ 3O_{2} \overset{t^{o}}{\rightarrow} 2N_{2} + 6H_{2}O$
- $4NH_{3} + 5O_{2} \overset{t^{o},pt,xt}{\rightleftharpoons } 4NO + 6H_{2}O$
4. Ứng dụng
Một số ứng dụng của ammonia:
- Tác nhân làm lạnh
- Sản xuất nitric acid
- Dung môi
- Sản xuất phân đạm
Ammonia có ứng dụng rộng rãi trong công nghiệp, nông nghiệp, y học và đời sống.
- Phần lớn ammonia được sử dụng làm phân bón như urea, đạm ammonium, ammophos
- Ammonia có nhiệt bay hơi lớn nên được dùng làm chất làm lạnh trong nhiều hệ thống làm công nghiệp, hệ thống điều hòa không khí tổng
- Ammonia là nguyên liệu trong sản xuất nitric acid theo phương pháp Ostwald, sản xuất soda theo phương pháp Solvey
- Ammonia lỏng là dung môi ion hóa được sử dụng khá phổ biến. Các kim loại kiềm tan vào ammonia lỏng tạo dung dịch màu xanh lam có chứa ion kim loại và electron
Ví dụ: Na(s) ⟶ Na$^{+}$(aq) + e$^{-}$(aq)
- Ngoài ra, ammonia được dùng trong xử lí môi trường, chất tẩy rửa bề mặt, kiểm soát pH của nước, trung hòa acid để bảo vệ thiết bị khỏi ăn mòn
5. Sản xuất
$N_{2}(g)+3H_{2}(g)\overset{t^{o},p,xt}{\rightleftharpoons }2NH_{3}(g)$; $\Delta _{r}H^{o}$ = -91,8 kJ
a) Nếu tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ (là chiều thu nhiệt, chiều nghịch), tăng nhiệt độ sẽ làm tăng tốc độ phản ứng nghịch
Ngược lại, nếu giảm nhiệt độ, cân bằng chuyển dịch theo chiều tỏa nhiệt (là chiều thuận) giảm nhiệt độ sẽ làm tăng tốc độ phản ứng thuận
b) Nếu giảm áp suất, cân bằng chuyển dịch theo chiều làm tăng áp suất (là chiều tăng số mol khí, chiều nghịch)
Ở áp suất càng cao thì yêu cầu về chất lượng thiết bị, an toàn lao động càng cao => tăng chi phí chế tạo, lắp đặt, vận hành, bảo dưỡng thiết bị
c) Chất xúc tác làm tăng cả tốc độ phản ứng thuận và phản ứng nghịch, làm hệ nhanh đạt đến trạng thái cân bằng
II. MUỐI AMMONIA
1. Tính tan, sự điện li
Hầu hết các muối ammonium đều dễ tan trong nước và phân li hoàn toàn ra ion
Ví dụ: $NH_{4}Cl\rightarrow NH_{4}^{+}+Cl^{-}$
2. Tác dụng với kiềm – Nhận biết ion ammonium
Đun nóng hỗn hợp muối ammonium với dung dịch kiềm sinh ra khí có mùi khai
Ví dụ: $(NH_{4})_{2}SO_{4}+2NaOH\overset{t^{o}}{\rightarrow}Na_{2}SO_{4}+2NH_{3}+2H_{2}O$
Phương trình ion rút gọn:
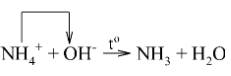
3. Tính chất kém bền nhiệt
Các muối ammonium đều kém bền nhiệt và dễ bị phân hủy khi nung nóng
Ví dụ:
- $NH_{4}Cl\overset{t^{o}}{\rightarrow}NH_{3}+HCl$
- $NH_{4}HCO_{3}\overset{t^{o}}{\rightarrow}NH_{3}+CO_{2}+H_{2}O$
- $NH_{4}NO_{3}\overset{t^{o}}{\rightarrow}N_{2}O+2H_{2}O$
4. Ứng dụng
Một số ứng dụng của muối ammonium:
- Chất đánh sạch bề mặt kim loại
- Thuốc long đờm
- Phân bón hóa học
- Chất phụ gia thực phẩm
- Thuốc bổ sung chất điện giải
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
Giải bài tập những môn khác
Giải sgk lớp 11 KNTT
Giải sgk lớp 11 CTST
Giải sgk lớp 11 cánh diều
Giải SBT lớp 11 kết nối tri thức
Giải SBT lớp 11 chân trời sáng tạo
Giải SBT lớp 11 cánh diều
Giải chuyên đề học tập lớp 11 kết nối tri thức
Giải chuyên đề toán 11 kết nối tri thức
Giải chuyên đề ngữ văn 11 kết nối tri thức
Giải chuyên đề vật lí 11 kết nối tri thức
Giải chuyên đề hóa học 11 kết nối tri thức
Giải chuyên đề sinh học 11 kết nối tri thức
Giải chuyên đề kinh tế pháp luật 11 kết nối tri thức
Giải chuyên đề lịch sử 11 kết nối tri thức
Giải chuyên đề địa lí 11 kết nối tri thức
Giải chuyên đề mĩ thuật 11 kết nối tri thức
Giải chuyên đề âm nhạc 11 kết nối tri thức
Giải chuyên đề công nghệ chăn nuôi 11 kết nối tri thức
Giải chuyên đề công nghệ cơ khí 11 kết nối tri thức
Giải chuyên đề tin học 11 định hướng Khoa học máy tính kết nối tri thức
Giải chuyên đề tin học 11 định hướng Tin học ứng dụng kết nối tri thức
Giải chuyên đề quốc phòng an ninh 11 kết nối tri thức
Giải chuyên đề hoạt động trải nghiệm hướng nghiệp 11 kết nối tri thức
Giải chuyên đề học tập lớp 11 chân trời sáng tạo
Giải chuyên đề học tập lớp 11 cánh diều
Trắc nghiệm 11 Kết nối tri thức
Trắc nghiệm 11 Chân trời sáng tạo
Trắc nghiệm 11 Cánh diều
Bộ đề thi, đề kiểm tra lớp 11 kết nối tri thức
Đề thi Toán 11 Kết nối tri thức
Đề thi ngữ văn 11 Kết nối tri thức
Đề thi vật lí 11 Kết nối tri thức
Đề thi sinh học 11 Kết nối tri thức
Đề thi hóa học 11 Kết nối tri thức
Đề thi lịch sử 11 Kết nối tri thức
Đề thi địa lí 11 Kết nối tri thức
Đề thi kinh tế pháp luật 11 Kết nối tri thức
Đề thi công nghệ cơ khí 11 Kết nối tri thức
Đề thi công nghệ chăn nuôi 11 Kết nối tri thức
Đề thi tin học ứng dụng 11 Kết nối tri thức
Đề thi khoa học máy tính 11 Kết nối tri thức
Bộ đề thi, đề kiểm tra lớp 11 chân trời sáng tạo
Bộ đề thi, đề kiểm tra lớp 11 cánh diều
Đề thi Toán 11 Cánh diều
Đề thi ngữ văn 11 Cánh diều
Đề thi vật lí 11 Cánh diều
Đề thi sinh học 11 Cánh diều
Đề thi hóa học 11 Cánh diều
Đề thi lịch sử 11 Cánh diều
Đề thi địa lí 11 Cánh diều
Đề thi kinh tế pháp luật 11 Cánh diều
Đề thi công nghệ cơ khí 11 Cánh diều
Đề thi công nghệ chăn nuôi 11 Cánh diều
Đề thi tin học ứng dụng 11 Cánh diều
Đề thi khoa học máy tính 11 Cánh diều

Bình luận