Lý thuyết trọng tâm hóa học 11 cánh diều bài 18: Hợp chất carbonyl
Tổng hợp kiến thức trọng tâm hóa học 11 cánh diều bài 18: Hợp chất carbonyl. Tài liệu nhằm củng cố, ôn tập lại nội dung kiến thức bài học cho học sinh dễ nhớ, dễ ôn luyện. Kéo xuống để tham khảo
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
I. KHÁI NIỆM VÀ DANH PHÁP
1. Khái niệm
Nhóm >C=O trong phân tử hợp chất hữu cơ được gọi là nhóm carbonyl
Aldehyde là hợp chất hữu cơ trong phân tử có nhóm -CHO liên kết trực tiếp với nguyên tử carbon hoặc nguyên tử hydrogen
Công thức chung của aldehyde no, đơn chức, mạch hở: CnH2n+1CH=O (n ≥ 0)
Ketone là hợp chất hữu cơ có nhóm carbonyl liên kết trực tiếp với hai nguyên tử carbon
2. Danh pháp
a) Tên thay thế
Tên aldehyde = Tên hydrocarbon (bỏ e) al
Ví dụ:
- HCHO: methanal
- CH3CHO: ethanal
- CH3CH(CH3)CHO: 2-methylpropanal
Tên ketone = Tên hydrocarbon (bỏ e) – vị trí nhóm carbonyl - one
Ví dụ:
- CH3COCH3: propanone
- CH3CH2COCH3: butanone
- CH3CH2CH2COCH3: pentan-2-one
b) Tên thông thường
Tên thông thường của aldehyde
- HCHO: formic aldehyde (formaldehyde)
- CH3CHO: acetic aldehyde (acetaldehyde)
- C6H5CHO: benzoic aldehyde (benzaldehyde)
- CH2=CH-CHO: acrylic aldehyde (acrylaldehyde)
- C6H5CH=CH-CHO: cinnamic aldehyde (cinnamaldehyde)
Tên thông thường của ketone
- CH3COCH3: acetone
- C6H5COCH3: acetophenone
II. TÍNH CHẤT VẬT LÍ
- Hai aldehyde đơn giản nhất (formic aldehyde và acetic aldehyde) là những chất khí ở nhiệt độ thường. Các hợp chất carbonyl khác là những chất lỏng hoặc chất rắn
- Các hợp chất carbonyl có nhiệt độ sôi thấp hơn các alcohol có cùng số nguyên tử carbon và cao hơn các hydrocarbon có phân tử khối tương đương
- Các hợp chất carbonyl mạch ngắn (chứa không quá ba nguyên tử carbon trong phân tử) tan tốt trong nước, còn các hợp chất carbonyl mạch dài hơn không tan hoặc ít tan trong nước.
III. TÍNH CHẤT HOÁ HỌC
1. Phản ứng khử hợp chất carbonyl
Aldehyde bị khử bằng NaBH4 hoặc LiAlH4 sinh ra alcohol bậc một; ketone bị khử bằng NaBH4 hoặc LiAlH4 sinh ra alcohol bậc hai
Ví dụ:
CH3-CH=O $\overset{LiAlH_{4}}{\rightarrow}$ CH3-CH2-OH
CH3-CO-CH3 $\overset{NaBH_{4}}{\rightarrow}$ CH3-CHOH-CH3
2. Phản ứng oxi hóa aldehyde
a) Phản ứng với nước bromine
Khi nhỏ nước bromine vào dung dịch ethanal thì thấy nước bromine mất màu:
CH3-CH=O + Br2 + H2O → CH3COOH + 2HBr
PTHH tổng quát khi cho aldehyde phản ứng với nước bromine:
R-CH=O + Br2 + H2O → R-COOH + 2HBr
b) Phản ứng với thuốc thử Tollens
Thuốc thử Tollens là dung dịch AgNO3 trong NH3 dư
AgNO3 + 3NH3 + H2O → [Ag(NH3)2]OH + NH4NO3
Phản ứng tổng quát giữa thuốc thử Tollens với aldehyde:
R-CH=O + 2[Ag(NH3)2]OH $\overset{t^{o}}{\rightarrow}$ R-COONH4 + 2Ag + 3NH3 + H2O
=> Phản ứng tráng bạc
c) Phản ứng với Cu(OH)2
Trong môi trường kiềm, Cu(OH)2 oxi hóa hầu hết các aldehyde thành muối carboxylate và sinh ra kết tủa Cu2O có màu đỏ gạch
HCHO + 2Cu(OH)2 + NaOH $\overset{t^{o}}{\rightarrow}$ HCOONa + Cu2O + 3H2O
Dùng thuốc thử Tollens hoặc Cu(OH)2 để phân biệt aldehyde với ketone
Thí nghiệm 1. Phản ứng oxi hóa aldehyde bằng thuốc thử Tollens
Nhỏ dung dịch ammonia vào ống nghiệm chứa silver nitrate thì xuất hiện kết tủa xám, sau đó kết tủa tan dần trong ammonia dư, tạo thành dung dịch trong suốt do tạo phức chất tan:
2AgNO3 + 2NaOH → Ag2O + 2NaNO3 + H2O
Ag2O + 4NH3 + H2O → 2[Ag(NH3)2]OH
Sau khi dung dịch acetaldehyde vào xuất hiện kết tủa nâu đen trong dung dịch. Sau một thời gian xung quanh thành ống nghiệm xuất hiện lớp bạc mỏng sáng như gương
CH3CHO + 2[Ag(NH3)2]OH $\overset{t^{o}}{\rightarrow}$ CH3COOH + 2Ag↓ + 3NH3 + H2O
Thí nghiệm 2. Phản ứng oxi hóa aldehyde bằng Cu(OH)2
Lúc đầu, ống nghiệm có kết tủa màu xanh da trời của Cu(OH)2
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Khi thêm tiếp CH3CHO rồi đun nóng hỗn hợp thấy xuất hiện kết tủa đỏ gạch
CH3CHO + 2Cu(OH)2 + NaOH $\overset{t^{o}}{\rightarrow}$ CH3COONa + Cu2O(đỏ gạch) + 3H2O
3. Phản ứng với hydrogen cyanide
Hydrogen cyanide (HCN) phản ứng được với aldehyde hoặc ketone tạo thành sản phẩm là các cyanohydrin
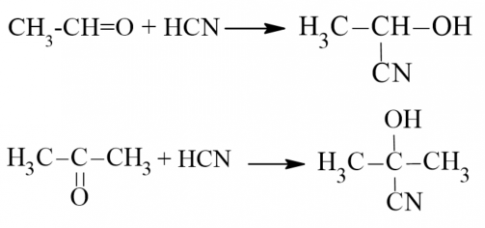
4. Phản ứng tạo iodoform
Khi cho hợp chất chứa nhóm methyl ketone (CH3CO-R) phản ứng với iodine trong môi trường kiềm tạo ra kết tủa iodoform màu vàng
Ví dụ: CH3CO-CH3 + 3I2 + 4NaOH → CH3-COONa + 3NaI + CHI3 + 3H2O
Thí nghiệm 3. Phản ứng tạo iodoform
Hiện tượng thí nghiệm: Thu được kết tủa màu vàng nhạt của CHI3
PTHH: CH3CHO + 3I + NaOH → CHI3↓ + H-COONa + 3NaI + 3H2O
V. ỨNG DỤNG VÀ ĐIỀU CHẾ
1. Ứng dụng
- Formaldehyde: được dùng chủ yếu để sản xuất nhựa; sản xuất phẩm nhuộm, chất nổ và dược phẩm; formalin dùng để ngâm xác động vật, tẩy uế, tiệt trùng
- Acetaldehyde: được dùng nhiều trong tổng hợp hữu cơ để điều chế nhiều dược phẩm hoặc các chất có ứng dụng trong thực tiễn
- Acetone: được dùng làm dung môi trong sản xuất tơ nhân tạo, thuốc súng không khói, tổng hợp hữu cơ,….
2. Điều chế
a) Điều chế acetaldehyde
2CH2=CH2 + O2 $\overset{xt,t^{o}}{\rightarrow}$ 2CH3-CH=O
b) Điều chế acetone
C6H5CH(CH3)2  CH3COCH3 + C6H5OH
CH3COCH3 + C6H5OH
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
Giải bài tập những môn khác
Giải sgk lớp 11 KNTT
Giải sgk lớp 11 CTST
Giải sgk lớp 11 cánh diều
Giải SBT lớp 11 kết nối tri thức
Giải SBT lớp 11 chân trời sáng tạo
Giải SBT lớp 11 cánh diều
Giải chuyên đề học tập lớp 11 kết nối tri thức
Giải chuyên đề toán 11 kết nối tri thức
Giải chuyên đề ngữ văn 11 kết nối tri thức
Giải chuyên đề vật lí 11 kết nối tri thức
Giải chuyên đề hóa học 11 kết nối tri thức
Giải chuyên đề sinh học 11 kết nối tri thức
Giải chuyên đề kinh tế pháp luật 11 kết nối tri thức
Giải chuyên đề lịch sử 11 kết nối tri thức
Giải chuyên đề địa lí 11 kết nối tri thức
Giải chuyên đề mĩ thuật 11 kết nối tri thức
Giải chuyên đề âm nhạc 11 kết nối tri thức
Giải chuyên đề công nghệ chăn nuôi 11 kết nối tri thức
Giải chuyên đề công nghệ cơ khí 11 kết nối tri thức
Giải chuyên đề tin học 11 định hướng Khoa học máy tính kết nối tri thức
Giải chuyên đề tin học 11 định hướng Tin học ứng dụng kết nối tri thức
Giải chuyên đề quốc phòng an ninh 11 kết nối tri thức
Giải chuyên đề hoạt động trải nghiệm hướng nghiệp 11 kết nối tri thức
Giải chuyên đề học tập lớp 11 chân trời sáng tạo
Giải chuyên đề học tập lớp 11 cánh diều
Trắc nghiệm 11 Kết nối tri thức
Trắc nghiệm 11 Chân trời sáng tạo
Trắc nghiệm 11 Cánh diều
Bộ đề thi, đề kiểm tra lớp 11 kết nối tri thức
Đề thi Toán 11 Kết nối tri thức
Đề thi ngữ văn 11 Kết nối tri thức
Đề thi vật lí 11 Kết nối tri thức
Đề thi sinh học 11 Kết nối tri thức
Đề thi hóa học 11 Kết nối tri thức
Đề thi lịch sử 11 Kết nối tri thức
Đề thi địa lí 11 Kết nối tri thức
Đề thi kinh tế pháp luật 11 Kết nối tri thức
Đề thi công nghệ cơ khí 11 Kết nối tri thức
Đề thi công nghệ chăn nuôi 11 Kết nối tri thức
Đề thi tin học ứng dụng 11 Kết nối tri thức
Đề thi khoa học máy tính 11 Kết nối tri thức
Bộ đề thi, đề kiểm tra lớp 11 chân trời sáng tạo
Bộ đề thi, đề kiểm tra lớp 11 cánh diều
Đề thi Toán 11 Cánh diều
Đề thi ngữ văn 11 Cánh diều
Đề thi vật lí 11 Cánh diều
Đề thi sinh học 11 Cánh diều
Đề thi hóa học 11 Cánh diều
Đề thi lịch sử 11 Cánh diều
Đề thi địa lí 11 Cánh diều
Đề thi kinh tế pháp luật 11 Cánh diều
Đề thi công nghệ cơ khí 11 Cánh diều
Đề thi công nghệ chăn nuôi 11 Cánh diều
Đề thi tin học ứng dụng 11 Cánh diều
Đề thi khoa học máy tính 11 Cánh diều

Bình luận