Giải SBT Hóa học 11 Chân trời bài 3: Đơn chất nitrogen
Giải chi tiết sách bài tập Hóa học 11 Chân trời bài 3: Đơn chất nitrogen. Tech12h sẽ hướng dẫn giải tất cả câu hỏi và bài tập với cách giải nhanh và dễ hiểu nhất. Hi vọng, thông qua đó học sinh được củng cố kiến thức và nắm bài học tốt hơn.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Bài 3.1: Ở trạng thái tự nhiên, nitrogen
A. tồn tại ở dạng đơn chất và hợp chất.
B. chỉ tồn tại ở dạng đơn chất.
C. chỉ tồn tại ở dạng hợp chất.
D. tự do chiếm khoảng 20% thể tích không khí.
Hướng dẫn trả lời:
Ở trạng thái tự nhiên, nitrogen tồn tại ở dạng đơn chất và hợp chất.
→ Chọn A.
Bài 3.2: Cấu hình electron nguyên tử của nitrogen là
A. 1s22s22p1.
B. 1s22s22p5.
C. 1s22s22p4.
D. 1s22s22p3.
Hướng dẫn trả lời:
N (Z = 7): 1s22s22p3
→ Chọn D.
Bài 3.3: Tính chất nào sau đây của nitrogen không đúng?
A. Ở điều kiện thường, nitrogen là chất khí.
B. Nitrogen tan rất ít trong nước.
C. Nitrogen không duy trì sự cháy và sự hô hấp.
D. Nitrogen nặng hơn không khí.
Hướng dẫn trả lời:
Chọn D.
Bài 3.4: Nitrogen trong không khí có vai trò nào sau đây?
A. Cung cấp đạm tự nhiên cho cây trồng.
B. Hình thành sấm sét.
C. Tham gia quá trình quang hợp của cây.
D. Tham gia hình thành mây.
Hướng dẫn trả lời:
Trong không khí, nitrogen cung cấp đạm tự nhiên cho cây trồng.
→ Chọn A.
Bài 3.5: a) Tại sao nitrogen là phi kim mạnh lại tồn tại được trong tự nhiên dưới dạng tự do?
b) Tại sao nitrogen phản ứng được với nhiều kim loại, nhưng trong vỏ Trái Đất không gặp một nitride (N3-) kim loại nào cả?
Hướng dẫn trả lời:
a) Nitrogen là phi kim mạnh, nhưng đơn chất nitrogen hoạt động hoá học kém ở nhiệt độ thường, tồn tại được trong tự nhiên (khí quyển) vì phân tử N2 có liên kết ba (N≡N) rất bền, không thể phân huỷ thành nguyên tử khi ở nhiệt độ thấp hoặc không có xúc tác.
b) N2 phản ứng với nhiều kim loại (với Li ở nhiệt độ thường và với Ca, Mg ở nhiệt độ cao) tạo ra các nitride kim loại (Li3N, Ca3N2, Mg3N2...). Thời kì đầu hình thành, Trái Đất rất nóng, tạo điều kiện cho nitrogen có thể tạo nitride với kim loại mạnh. Nhưng ở nhiệt độ này hydrogen và oxygen cũng đã hoá hợp với nhau tạo thành nước. Khi có mặt nước, các nitride kim loại đều bị thuỷ phân thành base kiềm và ammonia.
Bài 3.6: Viết phản ứng chứng minh nitrogen hoạt động hoá học ở nhiệt độ cao.
Hướng dẫn trả lời:
3Ca + N2 → Ca3N2
N2 + O2 → 2NO
Bài 3.7: Một bình kín có dung tích là 0,5 L chứa 1,5 mol H2 và 0,5 mol N2 ở nhiệt độ xác định. Ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Tính hằng số cân bằng KC của phản ứng xảy ra trong bình.
Hướng dẫn trả lời:
N2 + 3H2 → 2NH3
[N2] = 0,8M
[H2] = 2,4M
[NH3] = 0,4M
Kc = 0,014
Bài 3.8: Tại sao ở điều kiện thường (25 °C, 1 bar), nitrogen tồn tại ở dạng phân tử N2 trong khi đó phosphorus lại tồn tại ở dạng P4 mà không xảy ra trường hợp ngược lại? Biết:
– Năng lượng liên kết ba N≡N là 941 kJ/mol.
– Năng lượng liên kết ba P≡P là 490 kJ/mol.
– Năng lượng liên kết đơn N-N là 160 kJ/mol.
– Năng lượng liên kết đơn P-P là 209 kJ/mol.
Hướng dẫn trả lời:
+ Xét 4 nguyên tử P tạo thành:
- Phân tử P4 gồm 4 nguyên tử P liên kết với nhau bằng 6 liên kết đơn P-P.
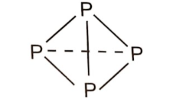
Năng lượng được giải phóng khi tạo một phân tử P4: 6 × 209 = 1254 (kJ).
- Phân tử P2 gồm 2 phân tử P≡P. Năng lượng được giải phóng khi tạo hai phân tử P2: 2 × 490 = 980 (kJ).
→ Phân tử P4 bền hơn P2 nên ở điều kiện thường, phosphorus trắng tồn tại ở dạng phân tử P4.
+ Xét 4 nguyên tử N tạo thành:
- Phân tử N4 gồm 4 nguyên tử N liên kết với nhau bằng 6 liên kết đơn N-N. Năng lượng được giải phóng khi tạo một phân tử N4: 6×160 = 960 (kJ).
- Phân tử N2 gồm 2 phân tử N≡N. Năng lượng được giải phóng khi tạo hai phân tử N2: 2 × 941 = 1882 (kJ).
=> Phân tử N2 bền hơn N4 ở điều kiện thường.
Bài 3.9: Xác định cụm từ phù hợp trong các ô từ (1) đến (7) để hoàn thành chu trình của nitrogen trong tự nhiên.
Hướng dẫn trả lời:
(1) Quá trình cố định đạm.
(2) Quá trình nitrate hóa bởi vi khuẩn.
(3) Quá trình hấp thu đạm của rễ cây.
(4) Động vật sử dụng thức ăn là thực vật.
(5) Động vật chết.
(6) Quá trình phân hủy xác động vật.
(7) Quá trình khử nitrogen.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
Giải bài tập những môn khác
Giải sgk lớp 11 KNTT
Giải sgk lớp 11 CTST
Giải sgk lớp 11 cánh diều
Giải SBT lớp 11 kết nối tri thức
Giải SBT lớp 11 chân trời sáng tạo
Giải SBT lớp 11 cánh diều
Giải chuyên đề học tập lớp 11 kết nối tri thức
Giải chuyên đề toán 11 kết nối tri thức
Giải chuyên đề ngữ văn 11 kết nối tri thức
Giải chuyên đề vật lí 11 kết nối tri thức
Giải chuyên đề hóa học 11 kết nối tri thức
Giải chuyên đề sinh học 11 kết nối tri thức
Giải chuyên đề kinh tế pháp luật 11 kết nối tri thức
Giải chuyên đề lịch sử 11 kết nối tri thức
Giải chuyên đề địa lí 11 kết nối tri thức
Giải chuyên đề mĩ thuật 11 kết nối tri thức
Giải chuyên đề âm nhạc 11 kết nối tri thức
Giải chuyên đề công nghệ chăn nuôi 11 kết nối tri thức
Giải chuyên đề công nghệ cơ khí 11 kết nối tri thức
Giải chuyên đề tin học 11 định hướng Khoa học máy tính kết nối tri thức
Giải chuyên đề tin học 11 định hướng Tin học ứng dụng kết nối tri thức
Giải chuyên đề quốc phòng an ninh 11 kết nối tri thức
Giải chuyên đề hoạt động trải nghiệm hướng nghiệp 11 kết nối tri thức
Giải chuyên đề học tập lớp 11 chân trời sáng tạo
Giải chuyên đề học tập lớp 11 cánh diều
Trắc nghiệm 11 Kết nối tri thức
Trắc nghiệm 11 Chân trời sáng tạo
Trắc nghiệm 11 Cánh diều
Bộ đề thi, đề kiểm tra lớp 11 kết nối tri thức
Đề thi Toán 11 Kết nối tri thức
Đề thi ngữ văn 11 Kết nối tri thức
Đề thi vật lí 11 Kết nối tri thức
Đề thi sinh học 11 Kết nối tri thức
Đề thi hóa học 11 Kết nối tri thức
Đề thi lịch sử 11 Kết nối tri thức
Đề thi địa lí 11 Kết nối tri thức
Đề thi kinh tế pháp luật 11 Kết nối tri thức
Đề thi công nghệ cơ khí 11 Kết nối tri thức
Đề thi công nghệ chăn nuôi 11 Kết nối tri thức
Đề thi tin học ứng dụng 11 Kết nối tri thức
Đề thi khoa học máy tính 11 Kết nối tri thức
Bộ đề thi, đề kiểm tra lớp 11 chân trời sáng tạo
Bộ đề thi, đề kiểm tra lớp 11 cánh diều
Đề thi Toán 11 Cánh diều
Đề thi ngữ văn 11 Cánh diều
Đề thi vật lí 11 Cánh diều
Đề thi sinh học 11 Cánh diều
Đề thi hóa học 11 Cánh diều
Đề thi lịch sử 11 Cánh diều
Đề thi địa lí 11 Cánh diều
Đề thi kinh tế pháp luật 11 Cánh diều
Đề thi công nghệ cơ khí 11 Cánh diều
Đề thi công nghệ chăn nuôi 11 Cánh diều
Đề thi tin học ứng dụng 11 Cánh diều
Đề thi khoa học máy tính 11 Cánh diều

Bình luận