Soạn giáo án điện tử hóa học 11 CTST Bài 2: Cân bằng trong dung dịch nước
Giáo án powerpoint hóa học 11 chân trời sáng tạo mới. Giáo án soạn theo tiêu chí hiện đại, đẹp mắt với nhiều hình ảnh, nội dung, hoạt động phong phú, sáng tạo. Giáo án điện tử này dùng để giảng dạy online hoặc trình chiếu. Tin rằng, bộ bài giảng này sẽ hỗ trợ tốt việc giảng dạy và đem đến sự hài lòng với thầy cô.
Xem hình ảnh về giáo án











Còn nữa....Giáo án khi tải về là bản đầy đủ. Có full siles bài giảng!
Nội dung giáo án
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC MỚI
KHỞI ĐỘNG
Ở lớp 8 các em đã được biết đến khái niệm acid, base. Các em hãy nhắc lại các khái niệm đó. Theo em làm cách nào có thể xác định nồng độ của dung dịch acid, base?
Trong chương trình lớp 8:
- Acid là hợp chất mà phân tử có một hay nhiều nguyên tử H liên kết với gốc acid, tan trong nước tạo ion H+
- Base là hợp chất mà phân tử có một nguyên tử kim loại liên kết với một hay nhiều nhóm OH. Base tan trong nước được gọi là kiềm, tạo ion OH-
BÀI 2. CÂN BẰNG TRONG DUNG DỊCH NƯỚC
NỘI DUNG BÀI HỌC
SỰ ĐIỆN LI, CHẤT ĐIỆN LI, CHẤT KHÔNG ĐIỆN LI
THUYẾT BRONSTED – LOWRY VỀ ACID – BASE
KHÁI NIỆM pH, CHẤT CHỈ THỊ ACID – BASE
CHUẨN ĐỘ ACID – BASE
Ý NGHĨA THỰC TIỄN CÂN BẰNG TRONG DUNG DỊCH NƯỚC CỦA ION Al3+, Fe3+ VÀ CO32
- SỰ ĐIỆN LI, CHẤT ĐIỆN LI, CHẤT KHÔNG ĐIỆN LI
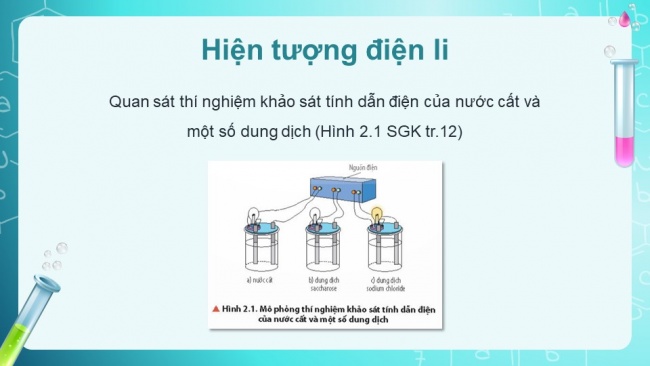
Hiện tượng điện li
Quan sát thí nghiệm khảo sát tính dẫn điện của nước cất và một số dung dịch (Hình 2.1 SGK tr.12)
Thảo luận và trả lời câu hỏi hoạt động 1 (SGK tr.12)
Quan sát hình 2.1 nhận xét hiện tượng xảy ra khi thực hiện thí nghiệm. So sánh tính dẫn điện của nước cất và các dung dịch.
Bóng đèn ở cốc đựng dung dịch Sodium Chloride (c) sáng
Bóng đèn ở cốc chứa nước cất (a) và bình chứa dung dịch saccharose (b) không sáng
Dung dịch sodium chloride dẫn điện.
Nước cất và dung dịch saccharose không dẫn điện.
Quan sát video mô phỏng quá trình hoà tan NaCl vào nước và hình 2.2
Hãy cho biết nguyên nhân vì sao dung dịch NaCl có tính dẫn điện?
Do NaCl trong dung dịch phân li thành các ion Na+ và Cl- là các phần tử mang điện điện nên dung dịch NaCl có tính dẫn điện.
Kết luậnQuá trình phân li các chất trong nước tạo thành các ion được gọi là sự điện li.
Sự phân loại các chất điện li
Cho các phản ứng sau đây:
HCl → H+ + Cl - (1)
CH3COOH ⇋ CH3COO- + H+ (2)
Quan sát hình 2.3, kết hợp 2 phản ứng trên và trả lời câu hỏi 3 (SGK tr.13)?
Quan sát hình 2.3, nhận xét về độ sáng của bóng đèn ở các thí nghiệm. Biết rằng nồng độ mol của các dung dịch bằng nhau, cho biết dung dịch nào dẫn điện mạnh, dẫn điện yếu và không dẫn điện.
Bóng đèn ở bình chứa dung dịch hydrochloric acid (a) sáng nhất
Dẫn điện mạnh
Bóng đèn ở bình chứa dung dịch acetic acid (b) sáng mờ
Dẫn điện yếu
Bóng đèn ở bình chứa dung dịch glucose (c) không sáng
Không dẫn điện
Phản ứng (1) là phản ứng 1 chiều
Phản ứng (2) là phản ứng thuận nghịch
Thảo luận nhóm trả lời CH thảo luận 4,5 (SGK tr.13,14):
- Từ phương trình (1) và (2) nhận xét mức độ phân li của HCl và CH3COOH trong nước
- Nếu nhỏ thêm vài giọt dung dịch NaOH hoặc CH3COONa vào dung dịch CH3COOH thì cân bằng (7) chuyển dịch theo chiều nào?
HCl → H+ + Cl - (1)
CH3COOH ⇋ CH3COO- + H+ (2)
HCl: phân li hoàn toàn trong nước theo phương trình điện li (1)
CH3COOH: phân li không hoàn toàn trong nước theo phương trình điện li (2)
Nếu nhỏ thêm vào dung dịch CH3COOH vài giọt dung dịch NaOH thì cân bằng (2) sẽ chuyển dịch theo chiều thuận (chiều tạo H+ và CH3COO-).
Nếu nhỏ vào dung dịch CH3COOH vài giọt dung dịch CH3COONa thì cân bằng (2) sẽ chuyển dịch theo chiều nghịch.
Kết luận
- Chất điện li mạnh là chất khi tan trong nước, các phân tử hoà tan đều phân li ra ion.
- Chất điện li yếu là chất khi tan trong nước chỉ có một phần phân li ra ion, phần còn lại tồn tại ở dạng phân tử trong dung dịch.
- Chất không điện li là chất khi hoà tan vào trong nước, các phân tử không phân li ra ion.
II THUYẾT BRONSTED – LOWRY VỀ ACID – BASE
=> Xem toàn bộ Giáo án điện tử Hóa học 11 chân trời sáng tạo
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
Xem thêm giáo án khác
GIÁO ÁN TỰ NHIÊN 11 CHÂN TRỜI SÁNG TẠO
Giáo án Toán 11 chân trời sáng tạo
Giáo án điện tử toán 11 chân trời sáng tạo
Giáo án Hóa học 11 chân trời sáng tạo
Giáo án điện tử Hóa học 11 chân trời sáng tạo
Giáo án Vật lí 11 chân trời sáng tạo
Giáo án điện tử vật lí 11 chân trời sáng tạo
Giáo án Sinh học 11 chân trời sáng tạo
Giáo án điện tử Sinh học 11 chân trời sáng tạo
GIÁO ÁN XÃ HỘI 11 CHÂN TRỜI SÁNG TẠO
Giáo án Ngữ văn 11 chân trời sáng tạo
Giáo án điện tử ngữ văn 11 chân trời sáng tạo
Giáo án Lịch sử 11 chân trời sáng tạo
Giáo án điện tử Lịch sử 11 chân trời sáng tạo
Giáo án Địa lí 11 chân trời sáng tạo
Giáo án điện tử địa lí 11 chân trời sáng tạo
Giáo án Kinh tế pháp luật 11 chân trời sáng tạo
Giáo án điện tử Kinh tế pháp luật 11 chân trời sáng tạo
GIÁO ÁN LỚP 11 CÁC MÔN CÒN LẠI
GIÁO ÁN LỚP 11 BỘ SÁCH KHÁC
Giáo án tất cả các môn lớp 11 kết nối tri thứcGiáo án tất cả các môn lớp 11 cánh diều
