Soạn giáo án điện tử hóa học 11 CTST Bài 1: Khái niệm về cân bằng hoá học
Giáo án powerpoint hóa học 11 chân trời sáng tạo mới. Giáo án soạn theo tiêu chí hiện đại, đẹp mắt với nhiều hình ảnh, nội dung, hoạt động phong phú, sáng tạo. Giáo án điện tử này dùng để giảng dạy online hoặc trình chiếu. Tin rằng, bộ bài giảng này sẽ hỗ trợ tốt việc giảng dạy và đem đến sự hài lòng với thầy cô.
Xem hình ảnh về giáo án











Còn nữa....Giáo án khi tải về là bản đầy đủ. Có full siles bài giảng!
Nội dung giáo án
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC MỚI
KHỞI ĐỘNG
- Trong các phản ứng hóa học, có một loại phản ứng trong đó các chất sản phẩm có khả năng phản ứng để tạo thành các chất đầu ® Phản ứng xảy ra không hoàn toàn và thường có hiệu suất không cao.
- Phản ứng tổng hợp ammonia từ nitrogen và hydrogen thuộc loại phản ứng này.
Các phản ứng này được gọi là phản ứng gì?
Để tăng hiệu suất, cần điều chỉnh những điều kiện phản ứng như nhiệt độ, áp suất, nồng độ,… như thế nào?
CHƯƠNG I. CÂN BẰNG HOÁ HỌC
BÀI 1. KHÁI NIỆM VỀ CÂN BẰNG HOÁ HỌC
NỘI DUNG BÀI HỌC
Phản ứng một chiều, phản ứng thuận nghịch và cân bằng hoá học
Hằng số cân bằng của phản ứng thuận nghịch
Sự chuyển dịch cân bằng hoá học
Các yếu tố ảnh hưởng đến cân bằng hoá học
- PHẢN ỨNG MỘT CHIỀU, PHẢN ỨNG THUẬN NGHỊCH VÀ CÂN BẰNG HOÁ HỌC
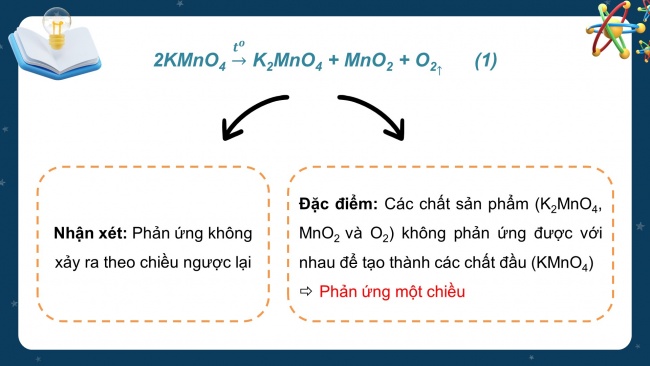
- Phản ứng điều chế khí oxygen trong phòng thí nghiệm bằng cách đun nóng tinh thể KMnO4 (thuốc tím) tạo thành K2MnO4, MnO2, O2 có phương trình hóa học như sau:
2KMnO4 K2MnO4 + MnO2 + O2 (1)
Câu hỏi thảo luận: Dựa vào phương trình hóa học của phản ứng điều chế khí oxygen từ KMnO4, em hãy cho biết phản ứng có xảy ra theo chiều ngược lại không?
Nhận xét: Phản ứng không xảy ra theo chiều ngược lại
Đặc điểm: Các chất sản phẩm (K2MnO4, MnO2 và O2) không phản ứng được với nhau để tạo thành các chất đầu (KMnO4)
- Phản ứng một chiều
Nhận xét
- Khái niệm: Phản ứng một chiều là phản ứng chỉ xảy ra theo chiều từ chất tham gia tạo thành sản phẩm mà sản phẩm không thể tác dụng lại với nhau để tạo thành chất ban đầu.
- Kí hiệu chiều phản ứng:
Ví dụ : NaOH + HCl NaCl + H2O
Vậy có phản ứng nào mà các chất sản phẩm lại phản ứng được với nhau để tạo thành chất đầu không ?
Phản ứng thuận nghịch
THẢO LUẬN NHÓM: Quan sát phản ứng sau và trả lời câu hỏi câu hỏi 2 (SGK tr.6)
Cl2(g) + H2O(l) HCl(aq) + HClO(aq) (2)
Phản ứng Cl2 tác dụng với H2O có đặc điểm gì khác với phản ứng nhiệt phân thuốc tím?
> Phản ứng trên xảy ra theo hai chiều, các chất sản phẩm tác dụng được với nhau tạo lại Cl2 và H2O
> Phản ứng thuận nghịch
Phản ứng thuận:
Cl2 + H2O HCl + HClO
Phản ứng nghịch:
HCl + HClO Cl2 + H2O
- Khái niệm: Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong cùng điều xác định.
- Kí hiệu chiều phản ứng: . Chiều từ trái sang phải là chiều thuận, chiều từ phải sang trái là chiều nghịch.
Ví dụ: 3O2 2O3
THẢO LUẬN NHÓM: Nghiên cứu trạng thái cân bằng hóa học thông qua phản ứng và trả lời câu hỏi 3, 4 (SGK tr.6)
N2(g) + 3H2(g) 2NH3(g)
Câu hỏi 3 (SGK tr.6). Quan sát Hình 1.1, nhận xét sự biến thiên nồng độ của các chất trong hệ phản ứng theo thời gian (với điều kiện nhiệt độ không đổi).
Trạng thái cân bằng
Câu hỏi 4 (SGK tr.6). Quan sát Hình 1.2, nhận xét về tốc độ của phản ứng thuận và tốc độ của phản ứng nghịch theo thời gian trong điều kiện nhiệt độ không đổi. Nồng độ các chất trong phản ứng thay đổi như thế?
Câu hỏi 3.
Theo thời gian: số mol N2, H2 giảm dần và đến một thời điểm ® Không thay đổi nữa
Theo thời gian: số mol NH3 tăng dần và đến cùng một thời điểm ® Không thay đổi nữa
Câu hỏi 4.
- Biểu thức định luật tác dụng khối lượng đối với phản ứng thuận:
vt = kt N2. H23
- Biểu thức định luật tác dụng khối lượng đối với phản ứng nghịch:
vn = kn NH32
Theo thời gian, số mol N2, H2 giảm dần
[N2] và [H2] giảm dần
Tốc độ phản ứng thuận giảm
Theo thời gian, số mol NH3 tăng dần
[NH3] tăng dần
Tốc độ phản ứng nghịch tăng
Nhận xét
- Trong thí nghiệm:
- Lúc đầu: Phản ứng thuận có tốc độ lớn hơn phản ứng nghịch, ưu tiên tạo ra ammonia.
- Theo thời gian: Tốc độ phản ứng thuận giảm dần, tốc độ phản ứng nghịch tăng dần đến khi tốc độ hai phản ứng bằng nhau.
- Tại thời điểm này: Số mol của các chất hydrogen, nitrogen, ammonia không thay đổi nữa.
- Thời điểm phản ứng thuận nghịch đạt tới trạng thái cân bằng.
Trạng thái cân bằng
=> Xem toàn bộ Giáo án điện tử Hóa học 11 chân trời sáng tạo
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
Xem thêm giáo án khác
GIÁO ÁN TỰ NHIÊN 11 CHÂN TRỜI SÁNG TẠO
Giáo án Toán 11 chân trời sáng tạo
Giáo án điện tử toán 11 chân trời sáng tạo
Giáo án Hóa học 11 chân trời sáng tạo
Giáo án điện tử Hóa học 11 chân trời sáng tạo
Giáo án Vật lí 11 chân trời sáng tạo
Giáo án điện tử vật lí 11 chân trời sáng tạo
Giáo án Sinh học 11 chân trời sáng tạo
Giáo án điện tử Sinh học 11 chân trời sáng tạo
GIÁO ÁN XÃ HỘI 11 CHÂN TRỜI SÁNG TẠO
Giáo án Ngữ văn 11 chân trời sáng tạo
Giáo án điện tử ngữ văn 11 chân trời sáng tạo
Giáo án Lịch sử 11 chân trời sáng tạo
Giáo án điện tử Lịch sử 11 chân trời sáng tạo
Giáo án Địa lí 11 chân trời sáng tạo
Giáo án điện tử địa lí 11 chân trời sáng tạo
Giáo án Kinh tế pháp luật 11 chân trời sáng tạo
Giáo án điện tử Kinh tế pháp luật 11 chân trời sáng tạo
GIÁO ÁN LỚP 11 CÁC MÔN CÒN LẠI
GIÁO ÁN LỚP 11 BỘ SÁCH KHÁC
Giáo án tất cả các môn lớp 11 kết nối tri thứcGiáo án tất cả các môn lớp 11 cánh diều
