Soạn giáo án điện tử hóa học 10 Chân trời bài 10. Liên kết cộng hoá trị
Giáo án powerpoint Hóa học 10 Chân trời sáng tạo mới bài [..]. Giáo án soạn theo tiêu chí hiện đại, đẹp mắt với nhiều hình ảnh, nội dung, hoạt động phong phú, sáng tạo. Giáo án điện tử này dùng để giảng dạy online hoặc trình chiếu. Tin rằng, bộ bài giảng này sẽ hỗ trợ tốt việc giảng dạy và đem đến sự hài lòng với thầy cô.







Còn nữa....Giáo án khi tải về là bản đầy đủ. Có full siles bài giảng!
Nội dung giáo án
CHÀO MỪNG CÁC EM ĐẾN VỚI BUỔI HỌC MÔN HOÁ
KHỞI ĐỘNG
Trong việc hình thành liên kết hóa học, ngoài việc cho và nhận electron hóa trị bằng liên kết ion, nguyên tử có thể sử dụng chung electron hóa trị để thỏa mãn quy tắc octet.
→ Một loại liên kết hóa học mới được hình thành. Đó là loại liên kết gì?
BÀI 10. LIÊN KẾT CỘNG HOÁ TRỊ
NỘI DUNG BÀI HỌC
SỰ TẠO THÀNH LIÊN KẾT CỘNG HOÁ TRỊ
LIÊN KẾT CHO – NHẬN
PHÂN BIỆT CÁC LOẠI LIÊN KẾT DỰA THEO ĐỘ ÂM ĐIỆN
SỰ HÌNH THÀNH LIÊN KẾT σ, π VÀ NĂNG LƯỢNG LIÊN KẾT
- SỰ HÌNH THÀNH LIÊN KẾT CỘNG HOÁ TRỊ
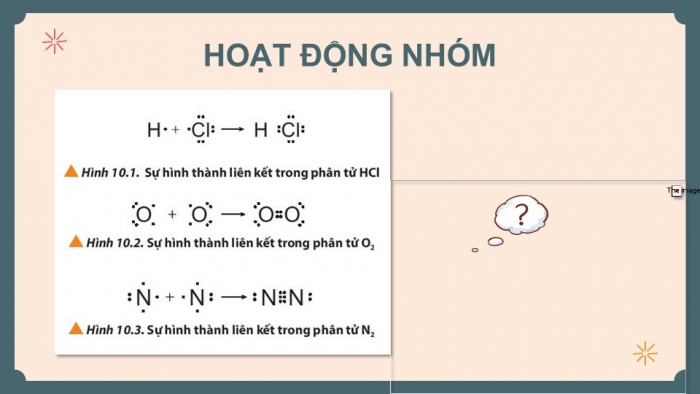
HOẠT ĐỘNG NHÓM
- Quan sát hình 10.1, 10.2, 3 (SGK tr.59).
- Giải thích mỗi nguyên tử trong phân tử đã:
- Góp bao nhiêu electron?
- Tạo bao nhiêu cặp electron chung?
- Đạt được cấu hình bền của khí hiếm nào?
CH1 (SGK tr.59). Quan sát các Hình 10.1 đến 10.3, cho biết quy tắc octet đã được áp dụng ra sao khi các nguyên tử tham gia hình thành liên kết.
Các nguyên tử trong mỗi phân tử đều tuân theo quy tắc octet bằng cách góp chung 1, 2 hoặc 3 electron khi chúng tham gia liên kết.
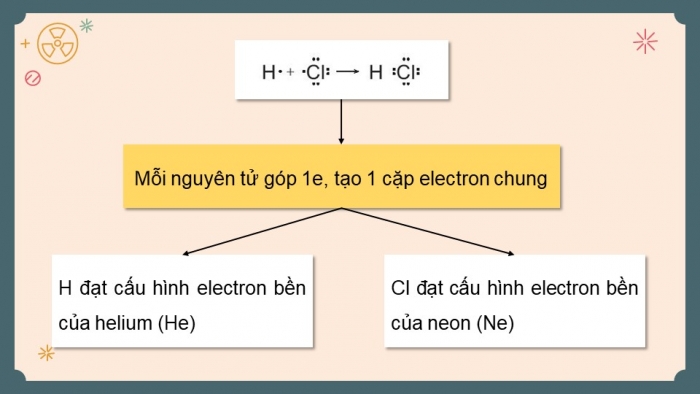
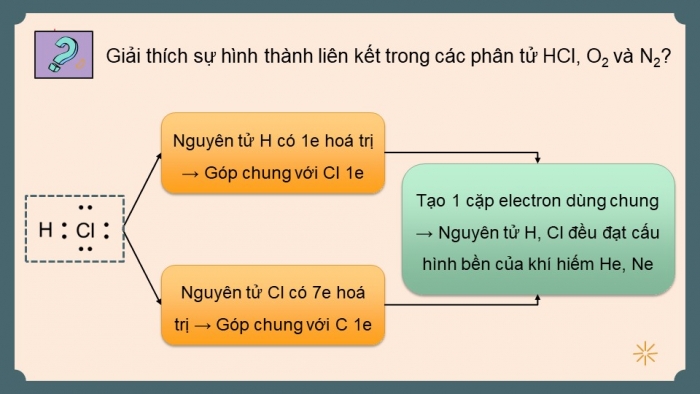
Phân tử HCl: Nguyên tử H đạt cấu hình bền của khí hiếm He, nguyên tử Cl đạt cấu hình bền của khí hiếm Ne.
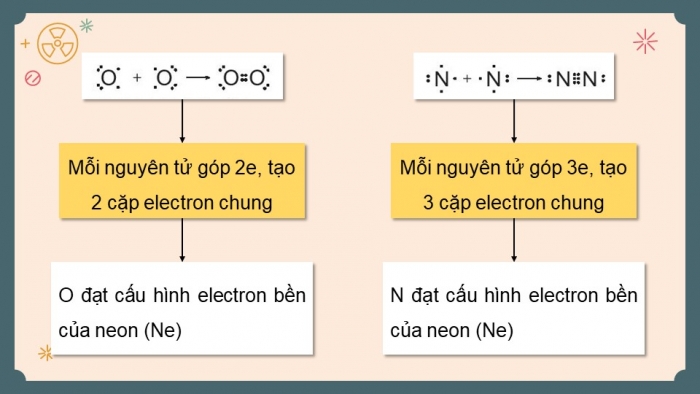
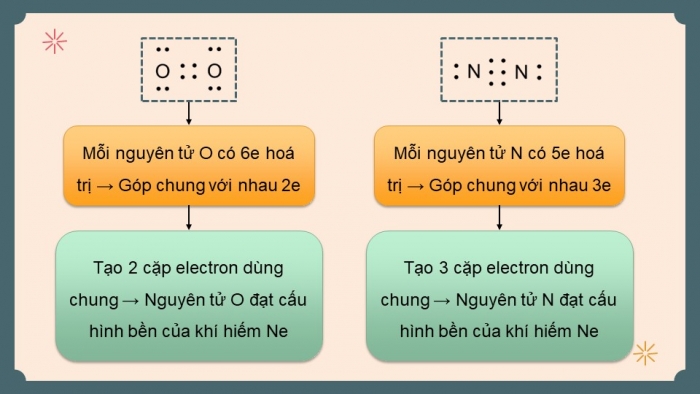
Phân tử O2: Nguyên tử O đều đạt cấu hình bền của khí hiếm Ne.
Phân tử N2: Nguyên tử N đều đạt cấu hình bền của khí hiếm Ne.
Giải thích sự hình thành liên kết trong các phân tử HCl, O2 và N2?
Mỗi nguyên tử O có 6e hoá trị → Góp chung với nhau 2e
Tạo 2 cặp electron dùng chung → Nguyên tử O đạt cấu hình bền của khí hiếm Ne
Mỗi nguyên tử N có 5e hoá trị → Góp chung với nhau 3e
Tạo 3 cặp electron dùng chung → Nguyên tử N đạt cấu hình bền của khí hiếm Ne
KẾT LUẬN
Liên kết cộng hóa trị là liên kết được hình thành giữa hai hay nhiều nguyên tử bằng một hay nhiều cặp electron dùng chung.
CH3 (SGK tr.60). Thế nào là liên kết đơn, liên kết đôi và liên kết ba?
Luyện tập (SGK tr.60). Trình bày sự hình thành liên kết cộng hóa trị trong phân tử Cl2.
Liên kết đơn, liên kết đôi, liên kết ba là các liên kết cộng hóa trị lần lượt được tạo nên bởi 1,2 , 3 cặp electron chung.
Nguyên tử Cl có 7e hoá trị
Tạo 1 cặp electron dùng chung
Mỗi nguyên tử trong phân tử Cl2 đều đạt cấu hình bền của khí hiếm Ne
Hãy viết công thức của HCl, O2 và N2 bằng cách thay thế mỗi cặp electron chung bằng 1 dấu gạch: “–“
Viết công thức Lewis
Nhóm 1
Viết công thức lewis của các chất sau lên bảng:
Nhóm 2
- Nhận xét cách viết.
- Giải thích bằng lời sự hình thành liên kết trong các phân tử tương ứng.
Giải thích:
- Nguyên tử H có 1e hoá trị → Góp chung với P 1e
- Nguyên tử P có 5e hoá trị → Góp chung với H 3e
- Tạo thành 3 cặp electron dùng chung.
- Mỗi nguyên tử trong phân tử HCl đều đạt cấu hình bền của khí hiếm He và Ar.
Giải thích:
- Nguyên tử H có 1e hoá trị → Góp chung với Br 1e
- Nguyên tử Br có 7e hoá trị → Góp chung với H 1e
- Tạo thành 1 cặp electron dùng chung.
- Mỗi nguyên tử trong phân tử HBr đều đạt cấu hình bền của khí hiếm He và Kr.
Giải thích:
- Nguyên tử H có 1e hoá trị → Mỗi nguyên tử góp chung 1e
- Nguyên tử C có 4e hoá trị → Mỗi nguyên tử góp chung 4e
- Tạo thành 7 cặp electron dùng chung.
- Mỗi nguyên tử trong phân tử C2H6 đều đạt cấu hình bền của khí hiếm He và Ne.
Luyện tập (SGK tr.60). Trình bày sự hình thành liên kết cộng hóa trị trong phân tử NH3
=> Xem toàn bộ Giáo án điện tử Hóa học 10 chân trời sáng tạo
Giáo án điện tử Hóa học 10 Chân trời sáng tạo, giáo án powerpoint Hóa học 10 chân trời [..], bài giảng điện tử Hóa học 10 CTST
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
