Quặng pyrite có thành phần chính là FeS2 được dùng làm nguyên liệu để sản xuất sulfuric acid. Xét phản ứng đốt cháy: FeS2 + O2 $\overset{t^{o}}{\rightarrow}$ Fe2O3 + SO2 a) Lập phương trình hoá học của phản ứng theo phương pháp thăng bằng electron. b)
16.15. Quặng pyrite có thành phần chính là FeS2 được dùng làm nguyên liệu để sản xuất sulfuric acid.
Xét phản ứng đốt cháy:
FeS2 + O2 $\overset{t^{o}}{\rightarrow}$ Fe2O3 + SO2
a) Lập phương trình hoá học của phản ứng theo phương pháp thăng bằng electron.
b) Tính thể tích không khí (chứa 21% thể tích oxygen, ở điều kiện chuẩn) cần dùng đề đốt cháy hoàn toàn 2,4 tấn FeS2 trong quặng pyrite.
a) Lập phương trình hoá học của phản ứng theo phương pháp thăng bằng electron.
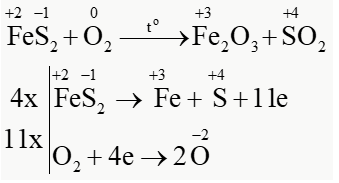
PTHH: 4FeS2 + 11O2 $\overset{t^{o}}{\rightarrow}$ 2Fe2O3 + 8SO2
b) $n_{FeS_{2}}=\frac{2,4.10^{6}}{120}$=$2.10^{4}$ (mol)
Theo PTHH: $n_{O_{2}}=\frac{11}{4}.n_{FeS_{2}}$ = $\frac{11}{4}.2.10^{4}$= 5,5.$10^{4}$ (mol)
$V_{O_{2}}$=24,79.5,5.$10^{4}$=1363450 L
⇒ Vkk=$\frac{100}{21}.V_{O_{2}}$= 6 492 619 L
Xem toàn bộ: Giải SBT Hoá 10 kết nối bài 16: Ôn tập chương 4

Bình luận