Những electron như thế nào được gọi là: a) Electron hóa trị b) Electron chung c) Electron hóa trị riêng
I. Công thức Lewis và mô hình VSEPR
1. Công thức Lewis
Câu hỏi 1. Những electron như thế nào được gọi là:
a) Electron hóa trị
b) Electron chung
c) Electron hóa trị riêng
Câu hỏi 2. Viết công thức cấu tạo của CO2 và H2O
Luyện tập 1: Viết công thức Lewis của CH4, BF3, SO3 và F2O
Câu hỏi 1.
a) Electron hóa trị là những electron có khả năng tham gia vào việc hình thành liên kết hóa học (thường là những electron ở lớp ngoài cùng hoặc ở phân lớp sát lớp ngoài cùng nếu phân lớp đó chưa bão hòa).
b) Electron chung là những electron hóa trị tham gia vào việc hình thành liên kết hóa học.
c) Electron hóa trị riêng là những electron hóa trị nhưng không tham gia vào việc hình thành liên kết hóa học.
Câu hỏi 2.
Công thức cấu tạo của CO2 là O = C = O
Công thức cấu tạo của H2O là H – O – H
Luyện tập 1:
Công thức Lewis của CH4:
Bước 1: Tính tổng số electron hóa trị (N1) của phân tử CH4
Carbon có 4 electron hóa trị, hydrogen có 1 electron hóa trị.
Trong CH4 có 1 nguyên tử carbon và 4 nguyên tử hydrogen. Vậy N1 = 1.4 + 4.1 = 8 (electron).
Bước 2: Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử:
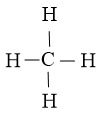
Số electron hóa trị đã dùng để xây dựng khung là N2 = 4.2 = 8 electron
Số electron hóa trị còn lại là N3 = N1 – N2 = 8 – 0 = 0
Vậy công thức Lewis của CH4 là

Công thức Lewis của BF3
Bước 1: Tính tổng số electron hóa trị (N1) của phân tử BF3
Boron có 3 electron hóa trị, fluorine có 7 electron hóa trị.
Trong phân tử BF3 có 1 nguyên tử boron và 3 nguyên tử fluorine. Vậy N1 = 1.3 + 3.7 = 24 electron
Bước 2: Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử
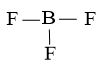
Số electron hóa trị đã dùng để xây dựng khung là N2 = 3.2 = 6 electron
Số electron hóa trị còn lại là N3 = N1 – N2 = 24 – 6 = 18 electron
Bước 3: Sử dụng 18 electron này để tạo octet cho F trước (vì F có độ âm điện cao hơn)
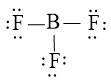
Bước 4: Nguyên tử B chưa được octet nên ta chuyển 1 cặp electron chưa liên kết của F tạo cặp electron chung
Vậy công thức Lewis của BF3
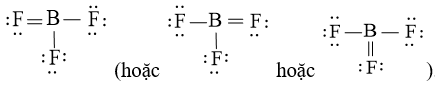
Công thức Lewis của SO3
Bước 1: Tính tổng số electron hóa trị (N1) của phân tử SO3
Sulfur có 6 electron hóa trị, oxygen có 6 electron hóa trị. Trong phân tử SO3, có 1 nguyên tử S và 3 nguyên tử O. Vậy N1 = 1.6 + 3.6 = 24 electron
Bước 2: Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử:
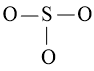
Số electron hóa trị đã dùng để xây dựng khung là N2 = 3.2 = 6 electron
Số electron hóa trị còn lại là N3 = N1 – N2 = 24 – 6 = 18 electron
Bước 3: Sử dụng N3 = 18 electron để tạo octet cho O trước (do O có độ âm điện lớn hơn)
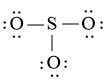
Bước 4: Đã sử dụng hết 18 electron để tạo octet cho O. Tuy nhiên S chưa đủ octet nên ta chuyển 1 cặp electron của nguyên tử O bên trái tạo thành cặp electron dùng chung.
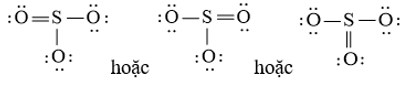
Công thức Lewis của F2O
Bước 1: Tính tổng số electron hóa trị (N1) của phân tử OF2
Flourine có 7 electron hóa trị, oxygen có 6 electron hóa trị.
Trong phân tử F2O có hai nguyên tử F và 1 nguyên tử O nên
⇒ Tổng số electron hóa trị N1 = 2.7 + 1.6 = 20 electron
Bước 2: Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử: F - O - F
Số electron hóa trị đã dùng để xây dựng khung là N2 = 2.2 = 4 electron
Số electron hóa trị còn lại là N3 = 20 – 4 = 16 electron
Bước 3: Sử dụng N3 = 16 electron để tạo octet cho F trước, sau đó tạo octet cho O.
Vậy công thức Lewis của F2O là ![]()

Bình luận