Đặc điểm dạng hình học khác nhau giữa AO lai hóa với AO s và với AO p là gì?
II. Sự lai hóa orbital
1. Khái niệm
2. Các dạng lai hóa phổ biến
Câu hỏi 4. Đặc điểm dạng hình học khác nhau giữa AO lai hóa với AO s và với AO p là gì?
Câu hỏi 5: Nguyên tử C trong CO2 có dạng lai hóa gì? Trình bày sự hình thành dạng lai hóa đó.
Câu hỏi 6: Khung phân tử acetone tạo bởi 3 nguyên tử C và 1 nguyên tử O có dạng tam giác phẳng theo mô hình VSEPR. Xác định dạng lai hóa của nguyên tử trung tâm C. Biết công thức của acetone là:
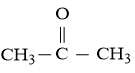
Luyện tập 4: Trình bày sự hình thành lai hóa sp3 của nguyên tử C trong CH4 và hình thành các liên kết trong phân tử này.
Câu hỏi 4
AO lai hóa có định hướng khác với AO s và AO p trong không gian. Do AO lai hóa là sự tổ hợp các AO của cùng một nguyên tử để tạo ra các AO mới có hình dạng như nhau nhưng có định hướng không gian khác nhau phù hợp với sự hình thành liên kết và dạng hình học phân tử tương ứng.
Câu hỏi 5
Công thức Lewis của CO2: ![]()
Từ công thức Lewis của CO2, xác định được phân tử này có dạng đường thẳng theo mô hình VSEPR.
Cấu hình electron của C (Z = 6) là 1s22s22p2. Để tạo liên kết với O, trước tiên có sự dịch chuyển 1 electron từ 2s lên 2p tạo cấu hình electron ở trạng thái kích thích là 1s22s12p3
Trong phân tử CO2, nguyên tử C phải có lai hóa sp giữa 2 AO (1 AO 2s và 1 AO 2p) để tạo ra 2 AO lai hóa (AO sp) cùng nằm trên một đường thẳng.
2 AO lai hóa này xen phủ trục với 2 AO 2p chứa electron độc thân của 2 nguyên tử O tạo thành liên kết σ.
Hai AO 2p không lai hóa của nguyên tử C có chứa electron độc thân xen phủ bên với 2AO 2p chứa electron độc thân còn lại của 2 nguyên tử O, tạo nên 2 liên kết π.
Câu hỏi 6
Phân tử acetone có dạng tam giác phẳng theo mô hình VSEPR.
Cấu hình electron của C (Z = 6) là 1s22s22p2. Cấu hình electron của C (Z = 6) ở trạng thái kích thích là 1s22s12p3
1 AO 2s tổ hợp với 2 AO 2p tạo 3 AO lai hóa sp2
3 AO lai hóa của nguyên tử C hướng về 3 đỉnh của một tam giác đều.
Luyện tập 4
Công thức Lewis của CH4 là
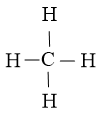
Từ công thức Lewis của CH4 ta xác định được phân tử này có dạng tứ diện theo mô hình VSEPR.
Cấu hình electron của C (Z = 6) là 1s22s22p2. Cấu hình electron của C (Z = 6) ở trạng thái kích thích là 1s22s12p3
1 AO 2s tổ hợp với 3 AO 2p tạo 4 AO lai hóa sp3
4 AO lai hóa sp3 của nguyên tử C xen phủ với 4 AO s của nguyên tử H tạo thành 4 liên kết σ hướng về 4 đỉnh của một tứ diện đều. (Hình 1,7


Bình luận