Hàm lượng iron(II) sulfate được xác định qua phản ứng ox- hoá - khử với potassium permanganate: FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O a) Lập phương trình hoá học của phân ứng theo phương pháp thăng bằng electron. Chỉ rõ chất oxi hoá, c
15.23. Hàm lượng iron(II) sulfate được xác định qua phản ứng ox- hoá - khử với potassium permanganate:
FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
a) Lập phương trình hoá học của phân ứng theo phương pháp thăng bằng electron. Chỉ rõ chất oxi hoá, chất khử.
b) Tính thể tích dung dịch KMnO4 0,02 M để phản ứng vừa đủ với 20 mL dung dịch FeSO4 0,10 M.
a)
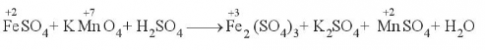

b)
$n_{KMnO_{4}}=\frac{2}{10}n_{FeSO_{4}}=\frac{2}{10}.0,02.0,1$=0,0004 (mol)
$V_{KMnO_{4}}=\frac{0,0004}{0,02}$=0,02 L = 20 (mL)
Từ khóa tìm kiếm Google: Giải sách bài tập hóa học 10 kết nối tri thức, giải SBT hóa học 10 KNTT, giải SBT hóa học 10 kết nối tri thức với cuộc sống bài 15: Phản ứng oxi hóa – khử

Bình luận