Câu hỏi tự luận mức độ vận dụng Hóa học 12 kntt bài 16: Điện phân
3. VẬN DỤNG (3 CÂU)
Câu 1: Thực hiện sự điện phân dung dịch CuSO4với một điện cực bằng graphit và một điện cực bằng đồng.
- Thí nghiệm 1: Người ta nối điện cực graphit với cực (+) và điện cực đồng với cực ( - ) của nguồn điện.
- Thí nghiệm 2: đảo lại, người ta nối điện cực graphit với cực ( - ) và điện cực đồng với cực (+) của nguồn điện .
a. Hãy mô tả hiện tượng quan sát được và cho biết phản ứng xảy ra ở mỗi điện cực trong các thí nghiệm trên
b. Hãy so sánh độ pH của dung dịch trong 2 thí nghiệm trên.
c. Hãy so sánh nồng độ ion Cu2+ trong dung dịch sau 2 thí nghiệm.
Câu 2: Xét quá trình sản xuất nhôm được thực hiện theo phương pháp điện phân Al2O3 nóng chảy với điện cực than chì. Trung bình để sản xuất được 1 tấn Al thì lượng điện cực than chì bị tiêu hao do phản ứng oxi hoá là bao nhiêu? Giả thiết thành phần khí bay ra ở cực dương gồm 50% CO và 50% CO2 về thể tích.
Câu 3: Cho 0,04 mol bột Fe vào dung dịch chứa 0,07 mol AgNO3. Khi phản ứng xảy ra hoàn toàn thì khối lượng chất rắn thu được là bao nhiêu
Câu 1:
Hiện tượng thí nghiệm 1: Graphite là anode (cực +), Cu là cathode ( cực -)
- Ở anode có bọt khí O2thoát ra; ở cathode có Cu bám lên, màu xanh của dung dịch nhạt dần
+ Cathode: Cu2+, H2O.
Cu2+ + 2e → Cu.
+ Anode: SO42-, H2O.
H2O → 2H+ + ![]() O2 + 2e.
O2 + 2e.
PTHH: CuSO4 + H2O ![]() Cu +
Cu + ![]() O2 + H2SO4.
O2 + H2SO4.
Hiện tượng thí nghiệm 2: Cực Cu (anode) bị tan, cực graphite (cathode) có Cu bám lên, màu xanh của dung dịch không đổi.
- Cathode: Cu2+ + 2e → Cu.
- Anode: Cu → Cu2+ + 2e.
Phương trình điện phân: Cuanode + Cu2+ → Cu2+ + Cucathode
b) Thí nghiệm 1: pH giảm (nồng độ H+ tăng), còn thí nghiệm 2: pH không đổi.
c) Thí nghiệm 1: nồng độ Cu2+ sau điện phân giảm, còn thí nghiệm 2: nồng độ Cu2+ không thay đổi trong quá trình điện phân.
Câu 2:
Đổi 1 tấn = 106 gam.
Số mol Al là: ![]() mol.
mol.
2Al2O3 ![]() 4Al + 3O2
4Al + 3O2
![]() →
→ 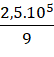 (mol)
(mol)
O2 + 2C ![]() 2CO
2CO
0,5x ← x ← x mol
Số mol O2 là: 0,5x + x = 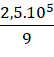 => x =
=> x = ![]() mol
mol
nC = x + x = 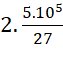 mol.
mol.
=> mC = 12.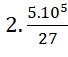 = 444444 gam = 0,44 tấn.
= 444444 gam = 0,44 tấn.
Câu 3:
Sử dụng phương trình cho – nhận e ta có:
Fe → Fe2+ + 2e Ag+ + 1e → Ag
0,035 ← 0,035 ← 0,07 0,07 → 0,07 → 0,07
Chất rắn thu được sau phản ứng gồm: Ag 0,07 mol và Fe dư 0,005 mol.
→ mrắn = 0,07.108 + 0,005.56 = 7.84 (g)
Xem toàn bộ: Câu hỏi tự luận Hóa học 12 Kết nối bài 16: Điện phân
Giải những bài tập khác
Giải bài tập những môn khác
Môn học lớp 12 KNTT
5 phút giải toán 12 KNTT
5 phút soạn bài văn 12 KNTT
Văn mẫu 12 KNTT
5 phút giải vật lí 12 KNTT
5 phút giải hoá học 12 KNTT
5 phút giải sinh học 12 KNTT
5 phút giải KTPL 12 KNTT
5 phút giải lịch sử 12 KNTT
5 phút giải địa lí 12 KNTT
5 phút giải CN lâm nghiệp 12 KNTT
5 phút giải CN điện - điện tử 12 KNTT
5 phút giải THUD12 KNTT
5 phút giải KHMT12 KNTT
5 phút giải HĐTN 12 KNTT
5 phút giải ANQP 12 KNTT
Môn học lớp 12 CTST
5 phút giải toán 12 CTST
5 phút soạn bài văn 12 CTST
Văn mẫu 12 CTST
5 phút giải vật lí 12 CTST
5 phút giải hoá học 12 CTST
5 phút giải sinh học 12 CTST
5 phút giải KTPL 12 CTST
5 phút giải lịch sử 12 CTST
5 phút giải địa lí 12 CTST
5 phút giải THUD 12 CTST
5 phút giải KHMT 12 CTST
5 phút giải HĐTN 12 bản 1 CTST
5 phút giải HĐTN 12 bản 2 CTST
Môn học lớp 12 cánh diều
5 phút giải toán 12 CD
5 phút soạn bài văn 12 CD
Văn mẫu 12 CD
5 phút giải vật lí 12 CD
5 phút giải hoá học 12 CD
5 phút giải sinh học 12 CD
5 phút giải KTPL 12 CD
5 phút giải lịch sử 12 CD
5 phút giải địa lí 12 CD
5 phút giải CN lâm nghiệp 12 CD
5 phút giải CN điện - điện tử 12 CD
5 phút giải THUD 12 CD
5 phút giải KHMT 12 CD
5 phút giải HĐTN 12 CD
5 phút giải ANQP 12 CD
Giải chuyên đề học tập lớp 12 kết nối tri thức
Giải chuyên đề Ngữ văn 12 Kết nối tri thức
Giải chuyên đề Toán 12 Kết nối tri thức
Giải chuyên đề Vật lí 12 Kết nối tri thức
Giải chuyên đề Hóa học 12 Kết nối tri thức
Giải chuyên đề Sinh học 12 Kết nối tri thức
Giải chuyên đề Kinh tế pháp luật 12 Kết nối tri thức
Giải chuyên đề Lịch sử 12 Kết nối tri thức
Giải chuyên đề Địa lí 12 Kết nối tri thức
Giải chuyên đề Tin học ứng dụng 12 Kết nối tri thức
Giải chuyên đề Khoa học máy tính 12 Kết nối tri thức
Giải chuyên đề Công nghệ 12 Điện - điện tử Kết nối tri thức
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Kết nối tri thức
Giải chuyên đề học tập lớp 12 chân trời sáng tạo
Giải chuyên đề Ngữ văn 12 Chân trời sáng tạo
Giải chuyên đề Toán 12 Chân trời sáng tạo
Giải chuyên đề Vật lí 12 Chân trời sáng tạo
Giải chuyên đề Hóa học 12 Chân trời sáng tạo
Giải chuyên đề Sinh học 12 Chân trời sáng tạo
Giải chuyên đề Kinh tế pháp luật 12 Chân trời sáng tạo
Giải chuyên đề Lịch sử 12 Chân trời sáng tạo
Giải chuyên đề Địa lí 12 Chân trời sáng tạo
Giải chuyên đề Tin học ứng dụng 12 Chân trời sáng tạo
Giải chuyên đề Khoa học máy tính 12 Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Điện - điện tử Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Chân trời sáng tạo
Giải chuyên đề học tập lớp 12 cánh diều
Giải chuyên đề Ngữ văn 12 Cánh diều
Giải chuyên đề Toán 12 Cánh diều
Giải chuyên đề Vật lí 12 Cánh diều
Giải chuyên đề Hóa học 12 Cánh diều
Giải chuyên đề Sinh học 12 Cánh diều
Giải chuyên đề Kinh tế pháp luật 12 Cánh diều
Giải chuyên đề Lịch sử 12 Cánh diều
Giải chuyên đề Địa lí 12 Cánh diều
Giải chuyên đề Tin học ứng dụng 12 Cánh diều
Giải chuyên đề Khoa học máy tính 12 Cánh diều
Giải chuyên đề Công nghệ 12 Điện - điện tử Cánh diều
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Cánh diều

Bình luận