Câu hỏi tự luận mức độ vận dụng cao Hóa học 12 kntt bài 16: Điện phân
4. VẬN DỤNG CAO (2 CÂU)
Câu 1: Ngâm một đinh sắt sạch trong 200 ml dung dịch CuSO4. Sau khi phản ứng kết thúc lấy đinh sắt ra khỏi dung dịch, rửa nhẹ, làm khô, nhận thấy khối lượng đinh sắt tăng thêm 0,8 g.
a) Viết phương trình hoá học của phản ứng dạng phân tử và ion thu gọn. Cho biết vai trò của các chất tham gia phản ứng.
b) Tính nồng độ mol của dung dịch CuSO4.
Giả thiết Cu giải phóng ra đều bám hết vào đinh sắt.
Câu 2: Sau một thời gian điện phân 200 ml dung dịch CuSO4 với điện cực graphite, khối lượng dung dịch giảm 8 gam. Để làm kết tủa hết ion Cu2+ còn lại trong dung dịch sau điện phân, cần dùng 100 ml dung dịch H2S 0,5 M.
Hãy xác định nồng độ mol và nồng độ phần trăm của dung dịch CuSO4 trước điện phân. Biết dung dịch CuSO4 ban đầu có khối lượng riêng là 1,25 g/ml.
Câu 1:
a) Fe + CuSO4 → FeSO4 + Cu (1)
Fe + Cu2+ → Fe2+ + Cu (2)
Chất khử chất oxi hóa
b) Theo (1) cứ 1 mol CuSO4 phản ứng làm khối lượng đinh sắt tăng 8 g
x mol → 0,8 g
x = 1.0,8:8 = 0,1 mol
Nồng độ mol của dung dịch CuSO4 là: 0,1.1000:200 = 0,5 M.
Câu 2:
CuSO4 + H2O ![]() Cu + H2SO4 +
Cu + H2SO4 + ![]() O2.
O2.
CuSO4 + H2S → CuS↓ + H2SO4
![]() .
.
mgiảm = mCu + ![]() = 8 gam.
= 8 gam.
Số mol CuSO4 bị điện phân bằng số mol Cu và bằng 0,1 mol.
Tổng số mol CuSO4 là: 0,1 + 0,05 = 0,15 mol.
Nồng độ CuSO4 ban đầu là: 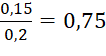 (M).
(M).
Xem toàn bộ: Câu hỏi tự luận Hóa học 12 Kết nối bài 16: Điện phân
Giải những bài tập khác
Giải bài tập những môn khác
Môn học lớp 12 KNTT
5 phút giải toán 12 KNTT
5 phút soạn bài văn 12 KNTT
Văn mẫu 12 KNTT
5 phút giải vật lí 12 KNTT
5 phút giải hoá học 12 KNTT
5 phút giải sinh học 12 KNTT
5 phút giải KTPL 12 KNTT
5 phút giải lịch sử 12 KNTT
5 phút giải địa lí 12 KNTT
5 phút giải CN lâm nghiệp 12 KNTT
5 phút giải CN điện - điện tử 12 KNTT
5 phút giải THUD12 KNTT
5 phút giải KHMT12 KNTT
5 phút giải HĐTN 12 KNTT
5 phút giải ANQP 12 KNTT
Môn học lớp 12 CTST
5 phút giải toán 12 CTST
5 phút soạn bài văn 12 CTST
Văn mẫu 12 CTST
5 phút giải vật lí 12 CTST
5 phút giải hoá học 12 CTST
5 phút giải sinh học 12 CTST
5 phút giải KTPL 12 CTST
5 phút giải lịch sử 12 CTST
5 phút giải địa lí 12 CTST
5 phút giải THUD 12 CTST
5 phút giải KHMT 12 CTST
5 phút giải HĐTN 12 bản 1 CTST
5 phút giải HĐTN 12 bản 2 CTST
Môn học lớp 12 cánh diều
5 phút giải toán 12 CD
5 phút soạn bài văn 12 CD
Văn mẫu 12 CD
5 phút giải vật lí 12 CD
5 phút giải hoá học 12 CD
5 phút giải sinh học 12 CD
5 phút giải KTPL 12 CD
5 phút giải lịch sử 12 CD
5 phút giải địa lí 12 CD
5 phút giải CN lâm nghiệp 12 CD
5 phút giải CN điện - điện tử 12 CD
5 phút giải THUD 12 CD
5 phút giải KHMT 12 CD
5 phút giải HĐTN 12 CD
5 phút giải ANQP 12 CD
Giải chuyên đề học tập lớp 12 kết nối tri thức
Giải chuyên đề Ngữ văn 12 Kết nối tri thức
Giải chuyên đề Toán 12 Kết nối tri thức
Giải chuyên đề Vật lí 12 Kết nối tri thức
Giải chuyên đề Hóa học 12 Kết nối tri thức
Giải chuyên đề Sinh học 12 Kết nối tri thức
Giải chuyên đề Kinh tế pháp luật 12 Kết nối tri thức
Giải chuyên đề Lịch sử 12 Kết nối tri thức
Giải chuyên đề Địa lí 12 Kết nối tri thức
Giải chuyên đề Tin học ứng dụng 12 Kết nối tri thức
Giải chuyên đề Khoa học máy tính 12 Kết nối tri thức
Giải chuyên đề Công nghệ 12 Điện - điện tử Kết nối tri thức
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Kết nối tri thức
Giải chuyên đề học tập lớp 12 chân trời sáng tạo
Giải chuyên đề Ngữ văn 12 Chân trời sáng tạo
Giải chuyên đề Toán 12 Chân trời sáng tạo
Giải chuyên đề Vật lí 12 Chân trời sáng tạo
Giải chuyên đề Hóa học 12 Chân trời sáng tạo
Giải chuyên đề Sinh học 12 Chân trời sáng tạo
Giải chuyên đề Kinh tế pháp luật 12 Chân trời sáng tạo
Giải chuyên đề Lịch sử 12 Chân trời sáng tạo
Giải chuyên đề Địa lí 12 Chân trời sáng tạo
Giải chuyên đề Tin học ứng dụng 12 Chân trời sáng tạo
Giải chuyên đề Khoa học máy tính 12 Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Điện - điện tử Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Chân trời sáng tạo
Giải chuyên đề học tập lớp 12 cánh diều
Giải chuyên đề Ngữ văn 12 Cánh diều
Giải chuyên đề Toán 12 Cánh diều
Giải chuyên đề Vật lí 12 Cánh diều
Giải chuyên đề Hóa học 12 Cánh diều
Giải chuyên đề Sinh học 12 Cánh diều
Giải chuyên đề Kinh tế pháp luật 12 Cánh diều
Giải chuyên đề Lịch sử 12 Cánh diều
Giải chuyên đề Địa lí 12 Cánh diều
Giải chuyên đề Tin học ứng dụng 12 Cánh diều
Giải chuyên đề Khoa học máy tính 12 Cánh diều
Giải chuyên đề Công nghệ 12 Điện - điện tử Cánh diều
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Cánh diều

Bình luận