Lý thuyết trọng tâm hóa học 11 cánh diều bài 15: Dẫn xuất halogen
Tổng hợp kiến thức trọng tâm hóa học 11 cánh diều bài 15: Dẫn xuất halogen. Tài liệu nhằm củng cố, ôn tập lại nội dung kiến thức bài học cho học sinh dễ nhớ, dễ ôn luyện. Kéo xuống để tham khảo
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
I. KHÁI NIỆM HỢP CHẤT HỮU CƠ VÀ HÓA HỌC HỮU CƠ
1. Khái niệm
Khi thay thế nguyên tử hydrogen của phân tử hydrocarbon bằng nguyên tử halogen được dẫn xuất halogen của hydrocarbon (gọi tắt là dẫn xuất halogen)
Trả lời Câu hỏi 1 SGK trang 100:
Hydrocarbon | Dẫn xuất halogen tương ứng |
CH4 | CH3Cl; CH2Cl2; CHCl3; CCl4; CH3Br; CHI3;.... |
CH3-CH2 | CH3CH2Cl; CH2BrCH2Br;,,, |
CH2=CH2 | CH2=CHCl; CF2=CF2;... |
C6H6 | C6H5Br;.... |
2. Đồng phân
Dẫn xuất halogen có đồng phân mạch carbon và đồng phân vị trí nhóm chức
Trả lời Câu hỏi 2 SGK trang 101:
(1) CH3-CH2-CH2-CH2-Cl
(2) CH3-CHCl-CH2-CH3
(3) 
(4) 
- Đồng phân mạch carbon: (1) và (4); (2) và (3)
- Đồng phân vị trí nhóm chức: (1) và (2); (3) và (4).
3. Danh pháp
Danh pháp thay thế: Số chỉ vị trí nhóm thế-tên nhóm thế tên mạch chính
Đánh số thứ tự chỉ vị trí nguyên tử carbon mạch chính sao cho tổng số của số chỉ vị trí của các nhóm thế là nhỏ nhất.
Đánh số từ phía đầu mạch gần liên kết bội đối với dẫn xuất halogen không no.
Ví dụ:
ClCH2CH2Cl: 1,2-dichloroethane
CH2=CHCH2Cl: 3-chloroprop-1-ene
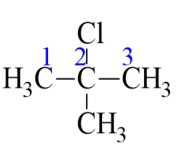 : 2-chloro-2-methylpropane
: 2-chloro-2-methylpropane
 : 1,3-dibromobenzene
: 1,3-dibromobenzene
Danh pháp thông thường:
- CHCl3: chloroform
- CHBr3: bromoform
- CHI3: iodoform
II. TÍNH CHẤT VẬT LÍ
Ở điều kiện thường, các dẫn xuất halogen có phân tử khối nhỏ ở thể khí, các dẫn xuất halogen có phân tử lớn ở thể lỏng.
Dẫn xuất halogen nặng hơn nước và hầu như không tan trong nước, tan tốt trong dung môi hữu cơ kém phân cực.
III. TÍNH CHẤT HOÁ HỌC
1. Phản ứng thế nguyên tử halogen bằng nhóm -OH
R–X + NaOH $\overset{t^{o}}{\rightarrow}$ R–OH + NaX
Với X là các halogen Cl, Br, I.
Thí nghiệm thủy phân dẫn xuất halogen
Hiện tượng: Xuất hiện kết tủa trắng AgX (Với X là Cl, Br, I)
Giải thích:
- Phản ứng thủy phân dẫn xuất halogen, tạo ra ion X-
R–X + NaOH $\overset{t^{o}}{\rightarrow}$ R–OH + NaX
- Sau đó nhỏ thêm dung dịch AgNO3, ion X- kết hợp với ion Ag+ tạo kết tủa AgX.
X- + Ag+ → AgX↓
2. Phản ứng tách hydrogen halide
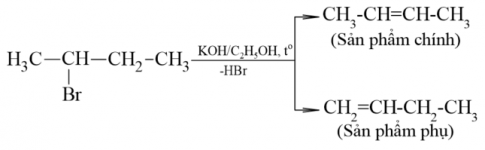
Hướng của phản ứng tách hydrogen halide: Trong phản ứng tách hydrogen halide, nguyên tử halogen tách ra cùng nguyên tử hydrogen ở nguyên tử carbon bên cạnh để tạo thành alkene.
Quy tắc Zaitsev: Trong phản ứng tách hydrogen halide ra khỏi dẫn xuất halogen, ưu tiên tách nguyên tử halogen cùng nguyên tử hydrogen ở nguyên tử carbon bên cạnh có bậc cao hơn
IV. ỨNG DỤNG CỦA DẪN XUẤT HALOGEN
- Làm dung môi, làm nguyên liệu: chloroform (CHCl3), carbon tetrachloride (CCl4),...
- Làm chất gây mê, giảm đau: chloroform (CHCl3), ethyl chlordide,...
- Thuốc trừ sâu: 2,4-D; 2,4,5-T,...
- Chất dùng trong công nghệ làm lạnh: chlorofluorocarbon (CFC), hydrofluorocarbon (HFC).
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
Giải bài tập những môn khác
Giải sgk lớp 11 KNTT
Giải sgk lớp 11 CTST
Giải sgk lớp 11 cánh diều
Giải SBT lớp 11 kết nối tri thức
Giải SBT lớp 11 chân trời sáng tạo
Giải SBT lớp 11 cánh diều
Giải chuyên đề học tập lớp 11 kết nối tri thức
Giải chuyên đề toán 11 kết nối tri thức
Giải chuyên đề ngữ văn 11 kết nối tri thức
Giải chuyên đề vật lí 11 kết nối tri thức
Giải chuyên đề hóa học 11 kết nối tri thức
Giải chuyên đề sinh học 11 kết nối tri thức
Giải chuyên đề kinh tế pháp luật 11 kết nối tri thức
Giải chuyên đề lịch sử 11 kết nối tri thức
Giải chuyên đề địa lí 11 kết nối tri thức
Giải chuyên đề mĩ thuật 11 kết nối tri thức
Giải chuyên đề âm nhạc 11 kết nối tri thức
Giải chuyên đề công nghệ chăn nuôi 11 kết nối tri thức
Giải chuyên đề công nghệ cơ khí 11 kết nối tri thức
Giải chuyên đề tin học 11 định hướng Khoa học máy tính kết nối tri thức
Giải chuyên đề tin học 11 định hướng Tin học ứng dụng kết nối tri thức
Giải chuyên đề quốc phòng an ninh 11 kết nối tri thức
Giải chuyên đề hoạt động trải nghiệm hướng nghiệp 11 kết nối tri thức
Giải chuyên đề học tập lớp 11 chân trời sáng tạo
Giải chuyên đề học tập lớp 11 cánh diều
Trắc nghiệm 11 Kết nối tri thức
Trắc nghiệm 11 Chân trời sáng tạo
Trắc nghiệm 11 Cánh diều
Bộ đề thi, đề kiểm tra lớp 11 kết nối tri thức
Đề thi Toán 11 Kết nối tri thức
Đề thi ngữ văn 11 Kết nối tri thức
Đề thi vật lí 11 Kết nối tri thức
Đề thi sinh học 11 Kết nối tri thức
Đề thi hóa học 11 Kết nối tri thức
Đề thi lịch sử 11 Kết nối tri thức
Đề thi địa lí 11 Kết nối tri thức
Đề thi kinh tế pháp luật 11 Kết nối tri thức
Đề thi công nghệ cơ khí 11 Kết nối tri thức
Đề thi công nghệ chăn nuôi 11 Kết nối tri thức
Đề thi tin học ứng dụng 11 Kết nối tri thức
Đề thi khoa học máy tính 11 Kết nối tri thức
Bộ đề thi, đề kiểm tra lớp 11 chân trời sáng tạo
Bộ đề thi, đề kiểm tra lớp 11 cánh diều
Đề thi Toán 11 Cánh diều
Đề thi ngữ văn 11 Cánh diều
Đề thi vật lí 11 Cánh diều
Đề thi sinh học 11 Cánh diều
Đề thi hóa học 11 Cánh diều
Đề thi lịch sử 11 Cánh diều
Đề thi địa lí 11 Cánh diều
Đề thi kinh tế pháp luật 11 Cánh diều
Đề thi công nghệ cơ khí 11 Cánh diều
Đề thi công nghệ chăn nuôi 11 Cánh diều
Đề thi tin học ứng dụng 11 Cánh diều
Đề thi khoa học máy tính 11 Cánh diều

Bình luận