Lý thuyết trọng tâm hóa học 10 cánh diều bài 11: Liên kết cộng hóa trị
Tổng hợp kiến thức trọng tâm hóa học 10 cánh diều bài 11: Liên kết cộng hóa trị. Tài liệu nhằm củng cố, ôn tập lại nội dung kiến thức bài học cho học sinh dễ nhớ, dễ ôn luyện. Kéo xuống để tham khảo
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
I. LIÊN KẾT CỘNG HÓA TRỊ
PHIẾU CHUYÊN SÂU 1
1. 1s$^{1}$
2. H có 1 electron ở lớp vỏ ngoài cùng: H·
3. Để đạt cấu hình bền vững giống với khí hiếm gần nó nhất là He 1s$^{2}$ thì H còn thiếu 1 electron.
Nguyên tử H có 1 electron lớp ngoài cùng, để đạt cấu hình khí hiếm gần nhất; mỗi nguyên tử góp chung 1
electron để tạo nên 1 cặp eletron dùng chung cho cả 2 nguyên tử.
=> Liên kết cộng hóa trị: Liên kết đơn
PHIẾU CHUYÊN SÂU 2
1. 1s$^{2}$2s$^{2}$2p$^{4}$.
2. O có 6 electron ở lớp vỏ ngoài cùng: :O:
3. Để đạt cấu hình bền vững giống với khí hiếm gần nó nhất thì O còn thiếu 2 electron.
- Sự hình thành liên kết trong phân tử O$_{2}$:
Nguyên tử O có 4 electron lớp ngoài cùng, để đạt cấu hình khí hiếm gần nhất; mỗi nguyên tử góp chung 2 electron để tạo nên 2 cặp eletron dùng chung cho cả 2 nguyên tử.
=> Liên kết cộng hóa trị: Liên kết đôi
PHIẾU CHUYÊN SÂU 3
1. 1s$^{2}$2s$^{2}$2p$^{3}$
2. N có 5 electron ở lớp vỏ ngoài cùng: :N:
3. Để đạt cấu hình bền vững giống với khí hiếm gần nó thì N còn 3 electron. Sự hình thành liên kết trong phân tử N$_{2}$:
Nguyên tử N có 5 electron lớp ngoài cùng, để đạt cấu hình khí hiếm gần nhất; mỗi nguyên tử góp chung 3 electron để tạo nên 3 cặp eletron dùng chung cho cả 2 nguyên tử.
=> Liên kết cộng hóa trị: Liên kết 3
PHIẾU MẢNH GHÉP 1 | ||||
H$_{2}$ | O$_{2}$ | N$_{2}$ | Cl$_{2}$ | |
Công thức electron | H:H | O::O | N:::N | Cl:Cl |
CTCT | H-H | O=O | N≡N | Cl-Cl |
Số liên kết giữa hai nguyên tử. | 1 | 2 | 3 | 1 |
Khái niệm liên kết cộng hóa trị | Liên kết cộng hóa trị là liên kết được hình thành bởi một hay nhiều cặp electron dùng chung giữa hai nguyên tử. | |||
Khái niệm liên kết cộng hóa trị không cực | Liên kết cộng hóa trị không phân cực: các cặp electron chung không bị hút lệch về phía nguyên tử nào. | |||
PHIẾU CHUYÊN SÂU 4
1. H (Z = 1) 1s$^{1}$; Cl (Z = 17) 1s$^{2}$2s$^{2}$2p$^{6}$3s$^{2}$3p$^{5}$
2. Số electron ở lớp ngoài cùng của nguyên tử H là 1 và Cl là 7.
3. Để đạt cấu hình bền vững giống với các khí hiếm gần nó nhất thì nguyên tử H và Cl đều còn thiếu 1 electron.
4. Sự hình thành liên kết trong phân tử HCl: Nguyên tử Cl và H đều còn thiếu 1 electron để đạt cấu hình của khí hiếm gần nhất. Vì vậy mỗi nguyên tử H và Cl đều góp chung 1 electron để tạo nên 1 cặp electron chung cho cả 2 nguyên tử
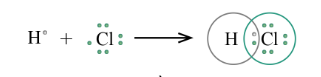
=> Liên kết cộng hóa trị: liên kết đơn
PHIẾU CHUYÊN SÂU 5
1. C (Z = 6) 1s$_{2}$2s$_{2}$2p$_{2}$ và O (Z = 8)1s$_{2}$2s$_{2}$2p$_{4}$
2. Số electron ở lớp ngoài cùng của nguyên tử C và O lần lượt là 4 và 6.
3. Để đạt cấu hình bền vững giống với các khí hiếm gần nó nhất thì C và O còn thiếu lần lượt là 4 và 2 electron.
4. Sự hình thành liên kết trong phân tử CO$_{2}$:
C và O còn thiếu lần lượt là 4 và 2 electron, để đạt được cấu hình khí hiếm gần nhất. Vì vậy nguyên tử C góp 4 electron, 2 nguyên tử O, mỗi nguyên tử góp 2 electron để tạo ra 4 cặp electron cùng chung .
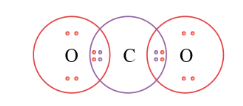
=> Liên kết cộng hóa trị: liên kết đôi
PHIẾU CHUYÊN SÂU 6
1. H (Z = 1) : 1s$^{1}$ và C (Z = 6) 1s$^{2}$2s$^{2}$2p$^{2}$
2. Số electron ở lớp ngoài cùng của nguyên tử H và C lần lượt là 1 và 4.
3. Để đạt cấu hình bền vững giống với các khí hiếm gần nó thì H và C thiếu lần lượt 1 và 4 electron.
4. Sự hình thành liên kết trong phân tử C$_{2}$H$_{2}$:
Xét 1 phân tử C$_{2}$H$_{2}$, mỗi nguyên tử H góp chung 1 electron, mỗi nguyên tử C góp chung 1 electron với nguyên tử H và góp chung 3 electron với nguyên tử C còn lại:
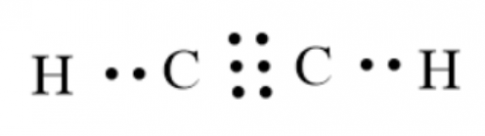
=> Liên kết cộng hóa trị: liên kết đơn và liên kết ba
HCl | CO$_{2}$ | C$_{2}$H$_{2}$ | |
Công thức electron |
|
|
|
CTCT | H – Cl | O = C = O | H – C ≡ C – H |
Loại liên kết (đơn, đôi, ba) giữa hai nguyên tử. | Liên kết đơn | Liên kết đôi | Liên kết ba |
Khái niệm liên kết cộng hóa trị có cực | - Là liên kết cộng hóa trị trong đó các cặp electron dùng chung bị lệch về phía một nguyên tử. | ||
Xác định sự phân cực của phân tử | Phân tử phân cực | Phân tử không phân cực | Phân tử không phân cực |
Biểu diễn công thức electron, công thức cấu tạo của phân tử SO$_{2}$:
| Công thức electron | Công thức cấu tạo |
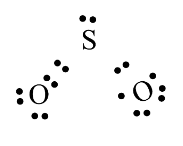 | 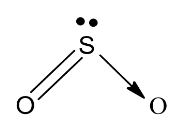 |
Giải thích: Trong phân tử SO$_{2}$:
- Nguyên tử S dùng 2 electron độc thân góp chung với 2 electron độc thân của một trong hai nguyên tử oxi.
- Nguyên tử S sử dụng một cặp electron để dung chung với nguyên tử oxi còn lại, tạo liên kết cho nhận.
=> Kết luận:
- Khái niệm liên kết cho nhận: Trong một số trường hợp, cặp electron chung chỉ do một nguyên tử đóng góp thì liên kết giữa hai nguyên tử là liên kết cho – nhận.
- Cách biểu diễn: Dấu mũi tên có chiều hướng về phía nguyên tử nhận “ →”
II. PHÂN LOẠI LIÊN KẾT THEO ĐỘ ÂM ĐIỆN
Hiệu độ âm điện (Δχ) | Δχ < 0,4 | 0,4 ≤ Δχ < 1,7 | Δχ ≥ 1,7 |
Loại liên kết | LK CHT không cực | LK CHT có cực | LK ion |
Đặc điểm cặp e chung | Không bị lệch | Bị lệch về một phía nguyên tử có độ âm điện lớn hơn. | Chuyển về một nguyên tử |
III. LIÊN KẾT SIGMA VÀ LIÊN KẾT PI
- Sự xen phủ trục tạo nên liên kết σ

- Sự xen phủ bên tạo nên liên kết

=> Kết luận:
- Sự xen phủ trục: Sự xen phủ trong đó trục của các obitan tham gia liên kết trùng với được đường nối tâm của hai nguyên tử liên kết.
- Sự xen phủ bên: Sự xen phủ trong đó trục của các obitan tham gia liên kết song song với nhau và vuông góc với đường nối tâm của hai nguyên tử liên kết.
IV. NĂNG LƯỢNG CỦA LIÊN KẾT CỘNG HÓA TRỊ
- Năng lượng liên kết là năng lượng cần thiết để phá vỡ một liên kết xác định trong phân tử ở thể khí, tại 25 độ C và 1 bar. Đơn vị: kJ.mol$^{-1}$
VD: Năng lượng để phá vỡ liên kết H-H trong 1 mol chất khí H$_{2}$ ở 25 độ C và 1 bar là 436 kJ
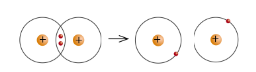
- Năng lượng liên kết càng lớn, liên kết đó càng bền.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây

Bình luận