Lý thuyết trọng tâm hóa học 10 cánh diều bài 10: Liên kết ion
Tổng hợp kiến thức trọng tâm hóa học 10 cánh diều bài 10: Liên kết ion. Tài liệu nhằm củng cố, ôn tập lại nội dung kiến thức bài học cho học sinh dễ nhớ, dễ ôn luyện. Kéo xuống để tham khảo
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
I. LIÊN KẾT ION
Nhóm A
1.1 Nguyên tử F (Z = 9)
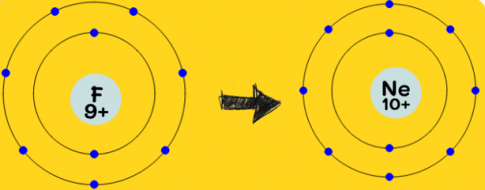
a) Số electron ở lớp ngoài cùng của nguyên tử F là 7.
b) Để đạt được lớp e ngoài cùng bền vững như Ne, nguyên tử F phải nhận 1 electron.
c) Sau khi nhận 1 electron, nguyên tử F sẽ trở thành anion.
Cấu hình e của ion đó: 1s$^{2}$2s$^{2}$2p$^{6}$
1.2
$Cl+1e\rightarrow Cl^{-}$
$S+2e\rightarrow S^{2-}$
$O+2e\rightarrow O^{2-}$
$X+me\rightarrow X^{m-}$ (m = 1,2)
1.3 Cấu hình electron của ion F$^{-}$, O$^{2-}$, S$^{2-}$ giống cấu hình electron của khí hiếm gần nó nhất.
Nhóm B
2.1 Nguyên tử Na (Z = 11)
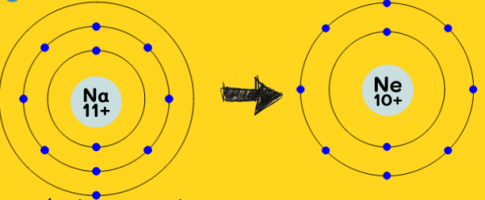
a) Số electron ở lớp ngoài cùng của nguyên tử Na là 1.
b) Để đạt được lớp e ngoài cùng bền vững như Ne, nguyên tử Na phải nhường 1 electron.
c) Sau khi nhường electron, nguyên tử Na sẽ trở thành cation.
Cấu hình e của ion đó: 1s$^{2}$2s$^{2}$2p$^{6}$
2.2
$Na\rightarrow Na^{+}+1e$
$Mg\rightarrow Mg^{2+}+2e$
$Al\rightarrow Al^{3+}+3e$
$M\rightarrow M^{n+}+ne$ (n = 1,2,3)
2.3 Cấu hình electron của ion Na$^{+}$, Mg$^{2+}$, Al$^{3+}$, K$^{+}$ giống cấu hình electron của khí hiếm gần nó nhất.
Nhóm mảnh ghép
3.1
Na: $1s^{2}2s^{2}2p^{6}3s^{1}$ $Na\rightarrow Na^{+}+1e$
Cl: $1s^{2}2s^{2}2p^{6}3s^{2}3p^{5}$ $Cl+1e\rightarrow Cl^{-}$
Các ion trái dấu hút nhau bằng lực hút tĩnh điện tạo nên hợp chất ion.
$Na^{+}+Cl^{-}\rightarrow NaCl$
3.2
- Ion đơn nguyên tử: Na$^{+}$, F$^{-}$, Al$^{3+}$, O$^{2-}$, S$^{2-}$.
- Ion đa nguyên tử: $SO_{4}^{-}$, $OH^{-}$.
3.3 Phân tử CaO
Ca: $1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}4s^{2}$
$Ca\rightarrow Ca^{2+}+2e$
Cl: $1s^{2}2s^{2}2p^{6}3s^{2}3p^{5}$
$2Cl+2.1e\rightarrow 2Cl^{-}$
Các ion trái dấu hút nhau bằng lực hút tĩnh điện tạo nên hợp chất ion.
$Ca^{2+}+2Cl^{-}\rightarrow CaCl_{2}$
Kết luận:
- Nguyên tử phi kim có xu hướng nhận thêm electron để trở thành ion âm hay anion (có cấu hình electron giống khí hiếm).
Tổng quát: $X+me\rightarrow X^{m-}$
- Nguyên tử kim loại có xu hướng nhường electron để trở thành ion dương hay cation (có cấu hình electron giống khí hiếm).
Tổng quát: $M\rightarrow M^{n+}+ne$
- Các ion có cấu tạo từ một nguyên tử là các ion đơn nguyên tử.
- Các ion có cấu tạo từ 2 hay nhiều nguyên tử trở lên là các ion đa nguyên tử.
- Liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
- Sự hình thành liên kết ion:
- Giai đoạn 1: Hình thành các ion trái dấu từ các quá trình kim loại nhường electron và phi kim nhận electron theo quy tắc octet.
- Giai đoạn 2: Các ion trái dấu hút nhau bằng lực hút tĩnh điện tạo nên hợp chất ion. Các ion trái dấu kết hợp với nhau theo tỉ lệ sao cho tổng điện tích của các ion trong hợp chất phải bằng 0.
$Na^{+}+Cl^{-}\rightarrow NaCl$
Chú ý: Liên kết ion được hình thành giữa kim loại điển hình và phi kim điển hình.
II. TINH THỂ ION
- Tinh thể ion là loại tinh thể được tạo nên bởi các cation và anion.
- Một số tinh thể: kim cương, than chì….
- Tinh thể ion: muối ăn.
- Đặc điểm của hợp chất ion: ở điều kiện thường:
- Tồn tại ở dạng tinh thể.
- Có nhiệt độ nóng chảy và nhiệt độ sôi khá cao.
- Tan nhiều trong nước.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây

Bình luận