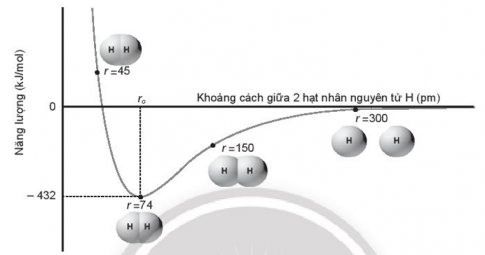
Giải SBT Hoá học 10 Chân trời bài 10 Liên kết cộng hóa trị
Hướng dẫn giải bài 10 Liên kết cộng hóa trị trang 34 SBT Hoá học 10. Đây là vở bài tập nằm trong bộ sách "Chân trời sáng tạo" được biên soạn theo chương trình đổi mới của Bộ giáo dục. Hi vọng, với cách hướng dẫn cụ thể và giải chi tiết học sinh sẽ nắm bài học tốt hơn.
Thêm kiến thức môn học
Từ khóa tìm kiếm: Giải sách bài tập hóa học 10 Chân trời sáng tạo, giải SBT hóa học 10 CTST, giải SBT hóa học 10 Chân trời sáng tạo bài 10 Liên kết cộng hoá trị




Bình luận