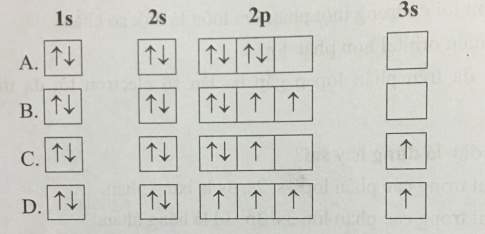
Giải SBT Hoá hoá 10 Cánh diều bài 5 Lớp, phân lớp và cấu hình electron
Hướng dẫn giải bài 5: Lớp, phân lớp và cấu hình electron trang 12 SBT Hoá học 10. Đây là vở bài tập nằm trong bộ sách "Cánh diều" được biên soạn theo chương trình đổi mới của Bộ giáo dục. Hi vọng, với cách hướng dẫn cụ thể và giải chi tiết học sinh sẽ nắm bài học tốt hơn.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
Từ khóa tìm kiếm: Giải sách bài tập hóa học 10 Cánh diều, giải SBT hóa học 10 CD, giải SBT hóa học 10 Cánh diều bài 5 Lớp, phân lớp và cấu hình electron


Bình luận