Đề thi giữa kì 1 Hóa học 10 CTST: Đề tham khảo số 4
Trọn bộ Đề thi giữa kì 1 Hóa học 10 CTST: Đề tham khảo số 4 bộ sách mới Chân trời sáng tạo gồm nhiều câu hỏi ôn tập hay, các dạng bài tập phong phú giúp các em củng cố ôn luyện lại kiến thức thật tốt chuẩn bị tốt cho kì thi sắp tới. Tài liệu có kèm theo đáp án và lời giải chi tiết. Hi vọng đây sẽ là tài liệu hữu ích giúp các em đạt điểm cao. Thầy cô và các em kéo xuống để tham khảo ôn luyện
| PHÒNG GD & ĐT ………………. | Chữ kí GT1: ........................... |
| TRƯỜNG THPT………………. | Chữ kí GT2: ........................... |
ĐỀ KIỂM TRA GIỮA HỌC KÌ 1
HÓA 10 – CHÂN TRỜI SÁNG TẠO
NĂM HỌC: 2023 – 2024
Thời gian làm bài: 60 phút (Không kể thời gian phát đề)
Họ và tên: …………………………………… Lớp:……………….. Số báo danh:…………………………….……PhòngKT:………….. | Mã phách |
"
Điểm bằng số
| Điểm bằng chữ | Chữ ký của GK1 | Chữ ký của GK2 | Mã phách |
A. PHẦN TRẮC NGHIỆM (7 điểm)
Khoanh tròn vào chữ cái đứng trước câu trả lời đúng:
Câu 1: Orbital nguyên tử là
A. đám mây chứa electron có dạng hình cầu.
B. đám mây chứa electron có dạng hình số 8 nổi.
C. khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron lớn nhất.
D. quỹ đạo chuyển động của electron quay quanh hạt nhân có kích thước năng lượng xác định.
Câu 2: Phát biểu nào sau đây đúng?
A. Những electron ở lớp K có mức năng lượng thấp nhất.
B. Những electron ở gần hạt nhân có mức năng lượng cao nhất.
C. Electron ở orbital 3p có mức năng lượng thấp hơn electron ở orbital 3s.
D. Các electron trong cùng một lớp có mức năng lượng bằng nhau.
Câu 3: Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 4 electron ở lớp L (lớp thứ hai). Số proton có trong nguyên tử X là
A. 7. B. 6. C. 8. D. 5.
Câu 4: Một nguyên tử được đặc trưng cơ bản bằng
A. Số proton và điện tích hạt nhân B. Số proton và số electron
C. Số khối A và số neutron D. Số khối A và điện tích hạt nhân
Câu 5: Kí hiệu nguyên tử nào sau đây được viết đúng?
A. ![]() . B. 16O C. 16N D.
. B. 16O C. 16N D. ![]()
Câu 6: Từ hai đồng vị chlorine (![]() và
và ![]() ) và đồng vị
) và đồng vị ![]() , số loại phân tử HCl có thể được tạo thành là
, số loại phân tử HCl có thể được tạo thành là
A. 1. B. 2. C. 3. D. 4.
Câu 7: Nguyên tố R có cấu hình electron: 1s22s22p3. Công thức hợp chất oxide ứng với hóa trị cao nhất của R và hydride (hợp chất của R với hydrogen) tương ứng là
A. R2O5, RH5. B. R2O3, RH.
C. R2O7, RH. D. R2O5, RH3.
Câu 8: Cho các nguyên tố M (Z = 11), X (Z = 17), Y (Z = 9) và R (Z = 19). Độ âm điện của các nguyên tố tăng dần theo thứ tự
A. M < X < Y < R. B. R < M < X < Y.
C. Y < M < X < R. D. M < X < R < Y.
Câu 9: Chromium được sử dụng nhiều trong luyện kim để chế tạo hợp kim chống ăn mòn và đánh bóng bề mặt. Nguyên tử chromium có cấu hình electron viết gọn là [Ar]3dd54s1. Vị trí chromium trong bảng tuần hoàn là
A. ô số 17, chu kì 4, nhóm IA B. ô số 24, chu kì 4, nhóm VIB
C. ô số 24, chu kì 3, nhóm VB D. ố số 27, chu kì 4, nhóm IB
Câu 10: Nguyên tố nào sau đây thuộc nhóm A?
A. [Ne]3s23p3. B. [Ar]3d14s2.
C. [Ar]3d74s2. D. [Ar]3d54s2
Câu 11: Nguyên tố X được sử dụng rộng rãi để chống đóng băng và khử băng như một chất bảo quản. Nguyên tố Y là nguyên tố thiết yếu cho các cơ thể sống, đồng thời nó được sử dụng nhiều trong việc sản xuất phân bón. Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử nguyên tố Y có một electron ở lớp ngoài cùng là 4s. Nguyên tử X và Y có số electron hơn kém nhau là 3. Nguyên tử X và Y lần lượt là
A. khí hiếm và kim loại. B. kim loại và khí hiếm.
C. kim loại và kim loại. D. phi kim và kim loại.
Câu 12: Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8. Nguyên tố X là
A. Si (Z=14). B. O (Z=8).
C. Al (Z=13). D. Cl (Z=17).
Câu 13: Phát biểu nào đúng khi nói về các orbital trong một phân lớp electron?
A. Có sự định hướng không gian. B. Có cùng mức năng lượng.
C. Khác nhau về mức năng lượng. D. Có hình dạng không phụ thuộc vào đặc điểm mỗi phân lớp.
Câu 14: Mỗi orbital nguyên tử chứa tối đa
A. 1 electron. B. 2 electron. C. 3 electron. D. 4 electron.
Câu 15: Cho các phát biểu sau:
(1) Tất cả các hạt nhân nguyên tử đều chứa proton và neutron.
(2) Khối lượng nguyên tử tập trung phần lớn ở lớp vỏ.
(3) Trong nguyên tử, số electron bằng số proton.
(4) Trong hạt nhân nguyên tử, hạt mang điện là proton và electron.
(5) Trong nguyên tử, hạt electron có khối lượng không đáng kể so với các hạt còn lại.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 16: Các nguyên tố từ Li đến F, theo chiều tăng của điện tích hạt nhân thì
A. bán kính nguyên tử tăng, độ âm điện giảm.
B. bán kính nguyên tử và độ âm điện đều tăng.
C. bán kính nguyên tử giảm, độ âm điện tăng.
D. bán kính nguyên tử và độ âm điện đều giảm.
Câu 17: Sắp xếp các hyđroxide NaOH, Al(OH)3, Mg(OH)2 theo chiều tăng dần tính base
A. NaOH, Mg(OH)2, Al(OH)3. B. Mg(OH)2, Al(OH)3, NaOH.
C. Al(OH)3, Mg(OH)2, NaOH. D. NaOH, Al(OH)3, Mg(OH)2.
Câu 18: Nguyên tố ở chu kì 5, nhóm VIIA có cấu hình electron hoá trị là.
A. 4s24p5 B. 5s25p5 C. 4d45s2 D. 7s27p3.
Câu 19: Nguyên tử A có 12 electron, 12 neutron, kí hiệu nguyên tử của A là
A. ![]() . B.
. B. ![]() . C.
. C. ![]() . D.
. D. ![]() .
.
Câu 20: Cấu hình electron của Cu (Z = 29) là
A. 1s2 2s2 2p6 3s2 3p6 3d10 4s1. B. 1s2 2s2 2p6 3s2 3p6 3d9 4s2.
C. 1s2 2s2 2p6 3s2 3p6 4s2 3d9. D. 1s2 2s2 2p6 3s2 3p6 4s2 3d10.
Câu 21: Hoà tan 6 gam kim loại X (hoá trị II) tác dụng vừa đủ 3,7185 lít khí Cl2 (ở 25oC, 1 bar). Kim loại X là
A. Ca. B. Zn. C. Ba. D. Mg.
Câu 22: X, Y là 2 nguyên tố kế tiếp nhau, thuộc cùng một chu kì trong bảng tuần hoàn các nguyên tố hoá học. Tổng số hiệu nguyên tử của X, Y là 29. X, Y lần lượt thuộc nhóm
A. IVA và VA. B. IIA và IIIA. C. IIIA và IVA. D. VA và VIA.
Câu 23: Nguyên tử của nguyên tố X có tổng số hạt electron trong các phân lớp p là 7. Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt. Các nguyên tố X và Y lần lượt là
A. Fe và Cl. B. Na và Cl. C. Al và Cl. D. Al và P.
Câu 24: Để tạo thành ion 20Ca2+ thì nguyên tử Ca phải:
A. Nhận 2 electron B. Cho 2 proton
C. Nhận 2 proton D. Cho 2 electron
Câu 25: Cho các phát biểu sau về các nguyên tố nhóm A, hãy chọn phát biểu sai ?
A. Electron cuối cùng phân bố trên phân lớp s hoặc p.
B. Số thứ tự nhóm nhóm A bằng số electron ngoài cùng.
C. Electron hóa trị bằng electron ngoài cùng.
D. Electron cuối cùng phân bố trên phân lớp d hoặc f.
Câu 26: Tổng số các hạt proton, neutron và electron trong nguyên tử của một nguyên tố là 40. Biết số hạt neutron lớn hơn số hạt proton là 1. Cho biết nguyên tố trên thuộc loại nguyên tố nào?
A. Nguyên tố s.
B. Nguyên tố p.
C. Nguyên tố d
D. Nguyên tố f
Câu 27: Có những tính chất sau đây của nguyên tố:
(1) Hóa trị của nguyên tố trong hợp chất với oxygen;
(2) Bán kính nguyên tử;
(3) Tính kim loại – phi kim;
(4) Tính acid – base của hợp chất hydroxide.
Trong các tính chất trên, số tính chất biến đổi tuần hoàn trong một nhóm A là
A. 1 B. 2 C. 3 D.4
Câu 28: Khi cho 3,36 g một kim loại thuộc phân nhóm chính nhóm I tác dụng với nước thì có 0,48 g khí H2 thoát ra. Vậy kim loại trên là
A. Li. B. Na. C. K D. Ca
PHẦN TỰ LUẬN (3 điểm)
Câu 1 (2đ): Cho 2 gam hỗn hợp hai kim loại X, Y ở hai chu kì liên tiếp và thuộc nhóm IIA tác dụng với dung dịch H2SO4 10%. Sau phản ứng thu được dung dịch Z và 1,568 lít khí H2 (đktc).
(a) Xác định hai kim loại X, Y.
(b) Tính khối lượng dung dịch H2SO4 đã dùng biết H2SO4 lấy dư 20% so với lượng phản ứng.
Câu 2 (1đ): Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số neutron. Tổng số proton trong phân tử XY2 là 32. Viết cấu hình electron của X và Y.
BÀI LÀM
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
%
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
TRƯỜNG THPT ........
HƯỚNG DẪN CHẤM KIỂM TRA GIỮA HỌC KÌ 1 (2023 – 2024)
MÔN: HÓA HỌC 10 – CHÂN TRỜI SÁNG TẠO
A. PHẦN TRẮC NGHIỆM: (7,0 điểm)
1-C | 2-A | 3-B | 4-D | 5-A | 6-B | 7-D |
8-B | 9-A | 10-A | 11-D | 12-A | 13-B | 14-B |
15-B | 16-C | 17-A | 18-B | 19-D | 20-A | 21. A |
22-A | 23-C | 24-D | 25- | 26-B | 27-C | 28-A |
B. PHẦN TỰ LUẬN: (5,0 điểm)
Câu | Nội dung đáp án | Biểu điểm |
Câu 1 (2 điểm) | (a) - Gọi công thức chung của hai kim loại X, Y là R (hóa trị II). PTHH: R + H2SO4 → RSO4 + H2↑ 0,07 0,07 0,07 (mol) Theo PTHH ta có: => Hai kim loại cần tìm là (b) Theo PTHH ta có: Vì lượng H2SO4 đã dùng dư 20% so với lượng phản ứng nên
Khối lượng dung dịch H2SO4 đã dùng là
|
0,5 đ
0,5 đ
0,5đ
0,5đ |
Câu 2 (1 điểm) | Gọi số hạt proton, neutron, electron của nguyên tử X là p, n, e và của Y là p’, n’, e’. Theo bài : ZX = NX ; ZY = NY Tổng số proton trong phân tử XY2 là 32 nên ZX + 2ZY = 32 (2) Từ (1), (2) => ZX = 16 (S); ZY = 8 (O) => Hợp chất XY2 là SO2. => Cấu hình electron của S: 1s22s22p63s23p4 và của O: 1s22s22p4 |
0,5 đ
0,5 đ |
Thêm kiến thức môn học
Đề thi Hóa học 10 Chân trời sáng tạo, trọn bộ đề thi Hóa học 10 Chân trời sáng tạo, Đề thi giữa kì 1 Hóa học 10

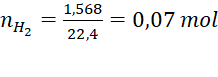
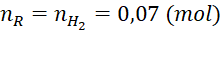
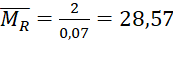
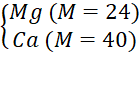
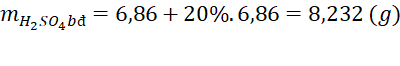

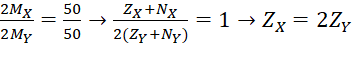
Bình luận