Đề thi giữa kì 1 Hóa học 10 CTST: Đề tham khảo số 2
Trọn bộ Đề thi giữa kì 1 Hóa học 10 CTST: Đề tham khảo số 2 bộ sách mới Chân trời sáng tạo gồm nhiều câu hỏi ôn tập hay, các dạng bài tập phong phú giúp các em củng cố ôn luyện lại kiến thức thật tốt chuẩn bị tốt cho kì thi sắp tới. Tài liệu có kèm theo đáp án và lời giải chi tiết. Hi vọng đây sẽ là tài liệu hữu ích giúp các em đạt điểm cao. Thầy cô và các em kéo xuống để tham khảo ôn luyện
PHÒNG GD & ĐT ………………. | Chữ kí GT1: ........................... |
TRƯỜNG THPT………………. | Chữ kí GT2: ........................... |
ĐỀ KIỂM TRA GIỮA HỌC KÌ 1
HÓA 10 – CHÂN TRỜI SÁNG TẠO
NĂM HỌC: 2023 – 2024
Thời gian làm bài: 60 phút (Không kể thời gian phát đề)
Họ và tên: …………………………………… Lớp:……………….. Số báo danh:…………………………….……PhòngKT:………….. | Mã phách |
"
Điểm bằng số
| Điểm bằng chữ | Chữ ký của GK1 | Chữ ký của GK2 | Mã phách |
A. PHẦN TRẮC NGHIỆM (7 điểm)
Khoanh tròn vào chữ cái đứng trước câu trả lời đúng:
Câu 1: Nội dung thuộc đối tượng nghiên cứu của hóa học là
A. sự chuyển động của vật trên máng nghiêng.
B. sự phân chia tế bào trong cơ thể.
C. sự chuyển hóa thức ăn trong hệ tiêu hóa.
D. sự chuyển động của Trái Đất.
Câu 2: Tính chất (vật lí và hóa học) của chất được quyết định bởi yếu tố nào sau đây?
A. Khối lượng.
B. Thể tích.
C. Phân tử khối.
D. Cấu tạo.
Câu 3: Quá trình nào sau đây thể hiện tính chất hóa học?
A. Hòa tan giấm ăn vào nước.
B. Hòa tan đường glucose vào nước.
C. Đun nóng đường saccharose đến khi xuất hiện chất màu đen.
D. Đun nước muối đến khi cạn khô.
Câu 4: Loại liên kết trong phân tử oxygen là
A. liên kết ion.
B. liên kết cộng hóa trị.
C. liên kết kim loại.
D. liên kết hydrogen.
Câu 5: Các hạt cấu tạo nên hạt nhân của hầu hết nguyên tử là
A. electron, proton và neutron.
B. electron và neutron.
C. proton và neutron.
D. electron và proton.
Câu 6: Phát biểu nào sau đây không đúng?
A. Hầu hết các nguyên tử được cấu tạo từ các hạt cơ bản là proton, neutron, electron.
B. Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử.
C. Hạt nhân nguyên tử cấu tạo bởi các hạt proton và hạt neutron.
D. Vỏ nguyên tử được cấu tạo từ các hạt electron.
Câu 7: Nguyên tử fluorine có 9 electron, hạt nhân nguyên tử này có điện tích là
A.+9. B. 9. C. 9+. D. -9.
Câu 8: Trong nguyên tử, hạt không mang điện là
A. electron.
B. proton.
C. neutron.
D. hạt nhân.
Câu 9: Cho kí hiệu nguyên tử:![]() . Điều khẳng định nào sau đây đúng?
. Điều khẳng định nào sau đây đúng?
A. Nguyên tử có 26 proton.
B. Nguyên tử có 26 neutron.
C. Nguyên tử có số khối 65.
D. Nguyên tử khối là 30.
Câu 10: Các đồng vị được phân biệt bởi yếu tố nào sau đây?
A. Số neutron.
B. Số hiệu nguyên tử.
C. Số lớp electron.
D. Số proton.
Câu 11: Trong tự nhiên copper (kí hiệu: Cu hay còn gọi là đồng) có hai đồng vị là ![]() chiếm 73% và
chiếm 73% và ![]() . Nguyên tử khối trung bình của nguyên tố Cu là
. Nguyên tử khối trung bình của nguyên tố Cu là
A. 63,54. B. 64,54. C. 64,00. D. 64,50.
Câu 12: Trong tự nhiên nguyên tố hydrogen có 3 đồng vị: ![]() . Hỏi có bao nhiêu loại phân tử H2 được tạo thành từ các loại đồng vị trên?
. Hỏi có bao nhiêu loại phân tử H2 được tạo thành từ các loại đồng vị trên?
A. 3. B. 6. C. 9. D. 12.
Câu 13: Electron thuộc lớp nào sau đây liên kết chặt chẽ với hạt nhân nhất?
A. Lớp N. B. Lớp M. C. Lớp K. D. Lớp L.
Câu 14: Lớp M có số electron tối đa là
A. 2. B. 8. C. 18. D. 32.
Câu 15: Mỗi AO chứa tối đa bao nhiêu electron?
A. 1 electron. B. 2 electron. C. 3 electron. D. 4 electron.
Câu 16: Xác suất tìm thấy electron trong toàn phần không gian bên ngoài đám mây electron là khoảng bao nhiêu phần trăm?
A. 90%. B. 100%. C. 10%. D. 0%.
Câu 17: Theo mô hình Rutherford – Bohr: Theo chiều từ hạt nhân ra ngoài lớp vỏ
A. năng lượng của các electron giảm dần.
B. năng lượng của các electron không đổi.
C. năng lượng của các electron tăng dần.
D. khối lượng của các electron tăng dần.
Câu 18: Các phân lớp s, p, d và f lần lượt có các số AO tương ứng là
A. 1; 4; 9; 16.
B. 1; 2; 3; 4.
C. 1; 3; 5; 7.
D. 2; 6; 10; 14.
Câu 19: Trong nguyên tử X, các electron được phân bố trên 3 lớp, lớp ngoài cùng có 3e. Vậy số đơn vị điện tích hạt nhân của X là
A. 13. B. 9. C. 15. D. 7.
Câu 20: Ở trạng thái cơ bản, nguyên tử nitrogen (Z = 7) có số electron độc thân là
A.0. B.2. C.3. D.1.
Câu 21: Một nguyên tử X có tổng số electron ở các phân lớp s là 6 và tổng số electron ở lớp ngoài cùng cũng là 6, cho biết X là nguyên tố hóa học nào sau đây?
A. O (Z = 8).
B. S (Z = 16).
C. Fe (Z = 26).
D. Cr (Z = 24).
Câu 22: Cho nguyên tố A có số hiệu nguyên tử bằng 11. A là nguyên tố
A. kim loại.
B. phi kim.
C. khí hiếm.
D. có thể là kim loại hoặc phi kim.
Câu 23: Khẳng định nào sau đây là đúng?
A. Các electron thuộc cùng một lớp có năng lượng bằng nhau, thuộc cùng một phân lớp có năng lượng gần bằng nhau.
B. Các electron thuộc cùng một lớp có năng lượng gần bằng nhau, thuộc cùng một phân lớp có năng lượng bằng nhau.
C. Các electron thuộc cùng một lớp, phân lớp đều có mức năng lượng bằng nhau.
D. Các electron thuộc cùng một lớp, phân lớp có mức năng lượng gần bằng nhau.
Câu 24: Bảng tuần hoàn các nguyên tố hóa học hiện nay gồm
A. 108 nguyên tố hóa học, 7 chu kì, 18 cột.
B. 118 nguyên tố hóa học, 7 chu kì, 16 cột.
C. 118 nguyên tố hóa học, 7 chu kì, 18 cột.
D. 108 nguyên tố hóa học, 7 chu kì, 16 cột.
Câu 25: Lớp electron thứ 4 có tên gọi là
A. Lớp N.
B. Lớp M.
C. Lớp K.
D. Lớp L.
Câu 26: Nguyên tố X có số thứ tự ô là 20. Xác định chu kì, nhóm của X trong bảng tuần hoàn các nguyên tố hóa học?
A. Chu kì 2, nhóm IA.
B. Chu kì 2, nhóm IVA.
C. Chu kì 3, nhóm IVA.
D. Chu kì 4, nhóm IIA.
Câu 27: X có cấu hình e ở phân lớp ngoài cùng là 3d34s2. X thuộc
A. chu kì 4, nhóm IIB.
B. chu kì 4, nhóm VB.
C. chu kì 4, nhóm IVA.
D. chu kì 4, nhóm IIA.
Câu 28: Số thứ tự của ô nguyên tố bằng
A. số hiệu nguyên tử của nguyên tố đó.
B. số lớp electron của nguyên tử nguyên tố đó.
C. số electron lớp ngoài cùng của nguyên tử nguyên tố đó.
D. tổng số electron lớp ngoài cùng và phân lớp sát lớp ngoài cùng của nguyên tử nguyên tố đó.
PHẦN TỰ LUẬN (3 điểm)
Câu 1 (1 điểm): Trong tự nhiên potassium (kí hiệu là: K) có hai đồng vị![]() và
và ![]() . Tính thành phần phần trăm về khối lượng của
. Tính thành phần phần trăm về khối lượng của ![]() có trong KCl (biết nguyên tử khối trung bình của K là 39,13 và Cl là 35,5).
có trong KCl (biết nguyên tử khối trung bình của K là 39,13 và Cl là 35,5).
Câu 2 (1 điểm): Nguyên tử nguyên tố X có tổng số hạt electron trong các phân lớp p là 7. Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt.
a) Viết cấu hình electron của X, Y.
b) Biểu diễn cấu hình electron của X, Y theo ô orbital, từ đó cho biết số electron độc thân của mỗi nguyên tử.
Câu 3 (1 điểm): Xác định vị trí của các nguyên tố dưới đây trong bảng tuần hoàn (có giải thích ngắn gọn):
(a) Nguyên tử của nguyên tố R có cấu hình electron lớp ngoài cùng là 3s23p4
(b) Nguyên tử của nguyên tố Y có 7 electron ở các phân lớp s.
BÀI LÀM
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
|
%
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
TRƯỜNG THPT ........
HƯỚNG DẪN CHẤM KIỂM TRA GIỮA HỌC KÌ 1 (2023 – 2024)
MÔN: HÓA HỌC 10 – CHÂN TRỜI SÁNG TẠO
A. PHẦN TRẮC NGHIỆM: (7,0 điểm)
1. C | 2. D | 3. C | 4. B | 5. C | 6. B | 7. A |
8. C | 9. A | 10. A | 11. A | 12. B | 13. C | 14. C |
15. B | 16. C | 17. C | 18. C | 19. A | 20. C | 21. B |
22. A | 23. B | 24. C | 25. A | 26. D | 27. B | 28. A |
B. PHẦN TỰ LUẬN: (5,0 điểm)
Câu | Nội dung đáp án | Biểu điểm |
Câu 1 (1 điểm) | Gọi phần trăm số nguyên tử của đồng vị ⇒ Phần trăm số nguyên tử của đồng vị là Áp dụng công thức tính nguyên tử khối trung bình ta có:
=> x = 93,5 Hạy trong tự nhiên đồng vị Giả sử có 1 mol KCl thì tổng số mol các đồng vị của K là 1 mol, trong đó số mol của
Vậy thành phần phần trăm về khối lượng của % |
0,5 đ
0,5 đ
|
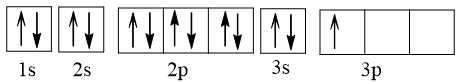
Câu 2 (1 điểm) | a) Cấu hình electron nguyên tử X là: 1s22s22p63s23p1. ⇒ X có 13 electron. Theo bài ra: 2ZY – 2ZX = 8 ⇒ ZY = 17. Cấu hình electron nguyên tử Y là: 1s22s22p63s23p5. b) + Biểu diễn cấu hình electron của X theo ô orbital:
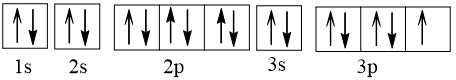
Vậy X có 1 electron độc thân. + Biểu diễn cấu hình electron của Y theo ô orbital:
Vậy Y có 1 electron độc thân. | 0,5 đ
0,5 đ
|
Câu 3 (1 điểm) | a) Cấu hình electron nguyên tử R: 1s22s22p63s23p4. Vậy R thuộc: + Ô thứ 16 (do số hiệu nguyên tử = số electron = 16); + Chu kì 3 (do nguyên tử có 3 lớp electron); + Nhóm VIA (do có 6 electron hóa trị, nguyên tố p hoặc do lớp ngoài cùng có dạng ns2np4). b) Cấu hình electron của Y: 1s22s22p63s23p64s1. Vậy Y thuộc: + Ô thứ 19 (do số hiệu nguyên tử = số electron = 19); + Chu kì 4 (do nguyên tử có 4 lớp electron); + Nhóm IA (do có 1 electron hóa trị, nguyên tố s). | 0,5đ
0,5đ |
Thêm kiến thức môn học
Đề thi Hóa học 10 Chân trời sáng tạo, trọn bộ đề thi Hóa học 10 Chân trời sáng tạo, Đề thi giữa kì 1 Hóa học 10

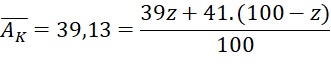
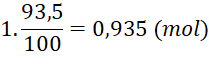
Bình luận